
Congreso de la Sociedad Americana de Hematología (ASH) Highlights
Cada mes de diciembre se celebra uno de los eventos de mayor importancia a nivel mundial en el campo de la Hematología; el 62do congreso tuvo la connotación de la pandemia de la COVID-19 que provocó su traslado total al mundo virtual. Un cambio en la forma pero que no afectó ni sus contenidos, así como su discusión y sobre todo, el aporte en varias recomendaciones de diagnóstico y tratamiento además de mostrar el camino al que la Medicina será conducida para el beneficio de nuestros pacientes. En la presente revisión abordaremos datos de impacto relacionados a la biología molecular, celular como su microambiente, novedades en diagnóstico y pronóstico.
Novedades moleculares y celulares en ASH 2020
El uso de Inmunomoduladores (IMIDs) constituye un eje del tratamiento del mieloma múltiple, sin embargo, los mecanismos de su resistencia no son muy conocidos; Barber y cols evaluaron a 56 pacientes del estudio UK NCRI Myeloma XI, encontrando que un 25% de pacientes portaban mutaciones en la vía del Cereblon y otros genes relacionados con la respuesta a dichos IMIDs; y cuando se encuentran dichas alteraciones, las líneas celulares muestran resistencia a otros IMIDs1. Liu evaluó el microambiente óseo para buscar causas de resistencia y encontró que la mutación de TRAF 2 (proteína relacionada con el factor de necrosis tumoral y que es, mediador de las señales antiapoptóticas de aquel) constituye una alteración independiente de la vía del cereblon para resistencia, adicionalmente potencializa el posible uso de inhibidores de MEK en combinación con IMIDs para este escenario2.
Revisamos factores que confieren resistencia, como son mutaciones en la vía del cereblon o mutaciones de TRAF entre otras. ¿Pero, hay elementos que conduzcan a la aparición del mieloma? El Grupo Español junto al grupo de estudio Inmunocell buscaron la concordancia entre médula y sangre de pacientes con mieloma asintomático, así como la evaluación de células tumorales circulantes. Encontraron una relación entre el número de estas células versus enfermedad estable o progresiva (0.02 vs. 0.11, p=0.005). Se predijo inclusive un alto riesgo de transformación entre aquellos pacientes que tuvieron 1 o menos células tumorales circulantes versus pacientes con más de 1 célula (8% vs. 47%, p<0.001) con una mediana de progresión de 6 meses3. En el estudio de GIMEMA se encuentra información similar con un corte de 0.07% en células tumorales circulantes considerando alto a un valor mayor del 0.07% mientras que valores iguales o menores a este se consideraron bajos. La supervivencia libre de progresión a 3 años fue menor en el grupo con alto número de células (47% vs. 78%); así también la Supervivencia Global a 3 años se afecta (78% vs. 93%). La evaluación de células tumorales circulantes se constituye así en un factor pronóstico independiente4.
Noticias sobre el microambiente en el Mieloma
Un elemento fundamental en el origen y desarrollo de las neoplasias es el microambiente tumoral y se ha identificado en ASH evidencia de efectos del microambiente en el sistema inmune y en el desarrollo de anemia.
Respecto al Sistema Inmune Manasanch presentó el estudio de 100 pacientes con mieloma asintomático; con una mediana de seguimiento de 24 meses, 10 pacientes progresaron a Mieloma múltiple y 2 pacientes a Amiloidosis de cadenas ligeras. Los análisis de citometría de flujo de médula ósea mostraron incremento de los ligandos inhibitorios (PD-L1/PD-L2) y B7-H3, CD200, HLA-E, HLA-G y CD59 en la progresión. Además se encontró mediante análisis de secuenciación completa del exoma(WES), mutaciones en KMT2C/E, NRAS/KRAS y FOXO3; esta alteración de vías relacionadas con el sistema inmune podría utilizarse, inclusive como evaluación pronostica para progresión aunque se necesitan estudios de validación5.
Respecto al desarrollo de anemia en los pacientes con mieloma se presentó la relación de CCL3; Hao evaluó en muestras de pacientes y ratones elementos relacionados a eritropoyesis. El regulador principal de la eritropoyesis GATA1 y KLF1 fue reducido en las células madre hematopoyéticas mientras que el gen de la citoquina CCL3 incrementaba su actividad; la inhibición se produce por la vía CCL3/CCR1/p38 y la supresión de los reguladores previamente mencionados. Además, antagonistas de CCR1 pueden inhibir efectivamente la actividad de CCL3, y por ende recuperar a GATA1 que se podría traducir en el rescate de la eritropoyesis por parte de las células madre6.
Innovaciones en el diagnóstico en ASH
Se ha utilizado a la tomografía por emisión de positrones con 18-F fluorodesoxiglucosa para la evaluación de mieloma (18F-FDG-PET/CT); sin embargo, la estandarización de los criterios de Deauville enfocadas a enfermedad mínima residual fue evaluada y presentadas en esta reunión. Zamagni revisó los resultados de dos estudios prospectivos que incluyeron a 288 pacientes elegibles para trasplante en los ensayos IFM/DFCI2009 y EMN02/H095. El seguimiento fue de 62.9 meses; al inicio, el 78.1% tenía lesiones focales (11% extramedulares); se demostró que una captación menor de 4 en la escala de Deauville a nivel de lesiones focales se asoció con una disminución del riesgo de muerte en un 66% (HR=0.34, p=0.004); así como una captación menor de 4 en médula ósea en un 75% (HR=0.25, p=0.005)7.
Noticias sobre pronóstico
A la luz de los nuevos tratamientos, podría pensarse que factores de mal pronóstico como son la deleción 17 p o Del(17p) así cómo la traslocación 4;14 o t(4;14) habrían sido mitigados por las nuevas terapias: Aquellas se encuentran en el 10% a 15% de los pacientes y son consideradas como factores adversos para la supervivencia. Chalopin presentó una evaluación de pacientes, provenientes de 5 centros franceses con diagnóstico inicial de mieloma múltiple, entre el año 2001 al 2009 con dichas anomalías cromosómicas. Se encontraron 246 pacientes, con una mediana de supervivencia global para los pacientes con del(17p) de 55.5 meses; 62.5 meses para los pacientes con t(4;14) y de 48.6 meses para pacientes con ambas anomalías. Lo que es fundamental en el estudio, es que no se encuentra un incremento de la supervivencia global entre los pacientes diagnosticados del 2001 al 2009 en comparación a los diagnosticados entre el 2010 al 2019 (63.7 meses versus 53.2 meses, p=0.32). Esto muestra que a pesar de los avances en terapia, estas dos anomalías siguen constituyendo tanto un factor pronóstico adverso como un reto para la investigación futura8.
Una de las principales investigaciones sobre pronóstico presentadas en ASH, es el trabajo de la red HARMONY de Europa. El mismo, que fue encabezado por D´Agostino, incluyó dentro de los criterios de estratificación de riesgo R-ISS a las alteraciones en el número de copias de 1q (CNAs); ya que previamente se habían evaluado como factor de mal desempeño en pacientes con mieloma de nuevo diagnóstico. Se incluyeron 7077 pacientes, con una mediana de seguimiento de 75 meses; la ampliación de los criterios con el uso de CNA permitió que 1372 pacientes (19,39%) sean distribuidos de mejor manera al grupo de riesgo Bajo-Intermedio (n=517), Intermedio-Alto (n=811) y Alto riesgo (n=44). De esta forma se afinan la estratificación de riesgo y se optimiza el uso de tratamientos9.
Figure 1. OS (A) and PFS (B) according to the newly defined risk groups. The dotted greys lines show the outcome of the same cohort of pts stratified by R-ISS.
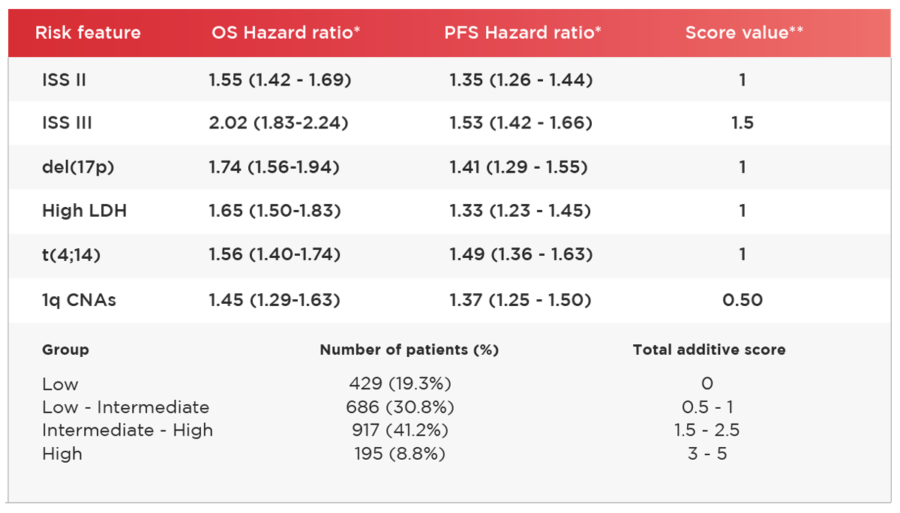
*Cox model adjusted for age, sex, therapy, performance status, isotype, t(14:16) and renal function
** Calculated on the risk of death in patients with complete data only (n=2227), value rounded at the nearest 0.5 with ISS II vs. I comparison as reference (score=1)
Abbreviations. OS, overall survival; PFS, progression- free survival; pts, patients; ISS, Internacional Staging System stage; LDH, lactate dehydrogenase; CNAs, copy-number abnormalities
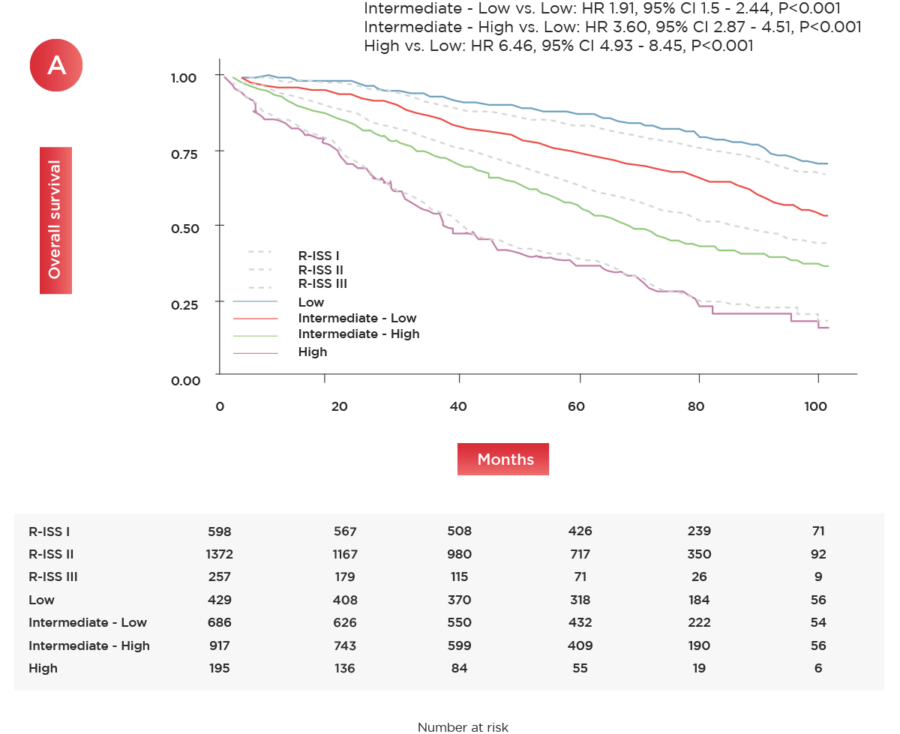
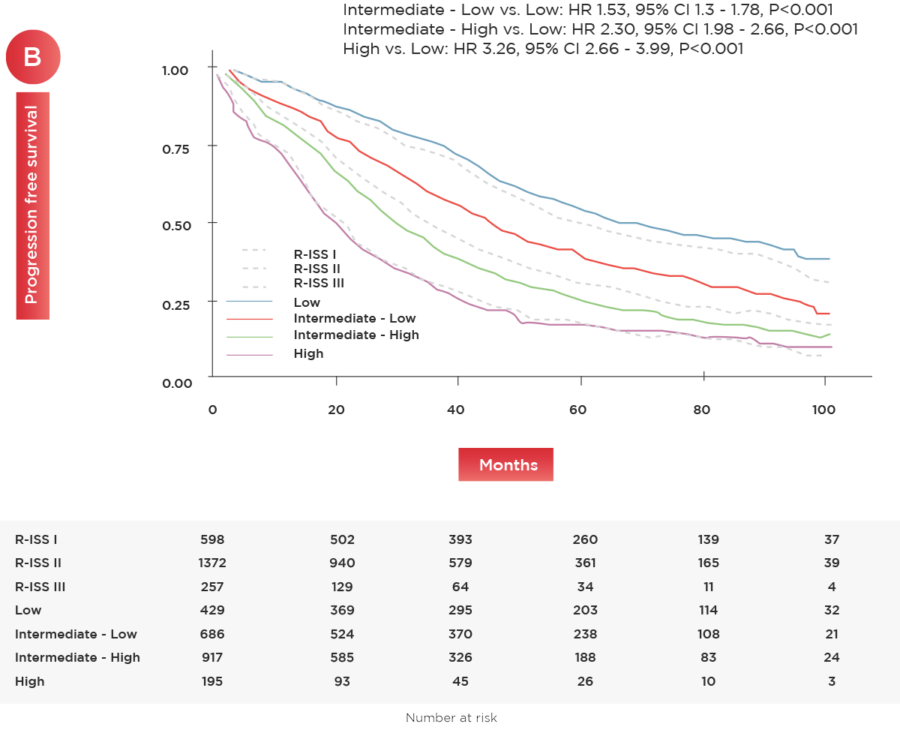
Abbreviations. OS, overall survival; PFS, progression- free survival; pts, patients; R-ISS, Revised Internacional Staging System stage; HR, hazard ratio; CI, confidence interval; P, p-value.
Conclusiones
- Se incrementa progresivamente el conocimiento de los distintos mecanismos de resistencia a terapias en Mieloma. La mutación de TRAF2, es uno de los mecanismos de resistencia independiente de la vía de cereblon para IMIDs.
- Se han identificado factores que promueven al tumor y la medición de células tumorales circulantes, se asocia con progresión de la enfermedad.
- En el microambiente tumoral; efectos a nivel de puntos clave del sistema inmune, se relacionan con el desarrollo de mieloma y elementos como CCL3 pueden tener relación con la aparición de anemia.
- En cuanto al diagnóstico, los criterios de Deauville pueden implementarse para la evaluación de la enfermedad mínima residual.
- Finalmente, elementos pronósticos adversos como anomalías citogenéticas a pesar de los nuevos tratamientos, mantienen su riesgo; y el uso de elementos adicionales para potenciar escalas pronósticas, muestra beneficio para clasificar de mejor manera a los pacientes y así, proveer mejores resultados.
Bibliografía
1.- Barber, A., Jones, J., Che, H., Le Bihan, Y., Weinhold, N., & Cody, A. et al. (2021). Mutations in CRBN and Other Cereblon Pathway Genes Are Only Associated with Acquired Resistance to Immunomodulatory Drugs in a Subset of Patients and Cell Line Models. Blood, 136(Supplement 1), 6-7.
2.- Liu, J., Hideshima, T., Xing, L., Wang, S., Ogiya, D., & Samur, M. et al. (2020). TRAF2 Mediates Sensitivity to Immunomodulatory Drugs in the Bone Marrow Microenvironment. Blood, 136 (Supplement 1), 36.
3.- Termini, R et al.. (2021). Longitudinal Immunogenomic Profiling of Tumor and Immune Cells for Minimally-Invasive Monitoring of Smoldering Multiple Myeloma (SMM): The Immunocell Study. Retrieved 7 January 2021, from https://ash.confex.com/ash/2020/webprogram/Paper136251.html.
4.- Bertamini, L. (2021). Poor Prognosis of Multiple Myeloma Predicted By High Levels of Circulating Plasma Cells Is Independent from Other High-Risk Features but Is Modulated By the Achievement of Minimal Residual Disease Negativity. Retrieved 7 January 2021, from https://ash.confex.com/ash/2020/webprogram/Paper137075.html.
5.- Manasanch, E. et al. (2021). Extensive Changes of the Immune Microenvironment Are Associated with Progression from Precursor Stages to Multiple Myeloma. Retrieved 19 January 2021, from https://ash.confex.com/ash/2020/webprogram/Paper137555.html.
6.- Hao, M. (2021). Multiple Myeloma Cell Defects Erythropoiesis and Results Anemia Via High Level of CCL3 in Bone Marrow Microenvironment. Retrieved 19 January 2021, from https://ash.confex.com/ash/2020/webprogram/Paper139006.html.
7.- Zamagni, E. (2021). Impact of Imaging FDG-PET/CT Minimal Residual Disease Assessment on Outcomes and Matching with Bone Marrow Techniques in Newly Diagnosed Transplant Eligible Multiple Myeloma (MM) Patients: Results of the Phase II Randomized Forte Trial. Retrieved 10 January 2021, from https://ash.confex.com/ash/2020/webprogram/Paper137412.html.
8.- Chalopin, T., Vallet, N., Ochman, M., Tiab, M., Godmer, P., & Barin, C. et al. (2020). Survival Trends over 18 Years of Patients with Multiple Myeloma Harboring Del(17p) and/or t(4;14): A Retrospective Real-World Study. Blood, 136(Supplement 1), 15-17.
9.- D’Agostino, M., et al. (2021). A New Risk Stratification Model (R2-ISS) in Newly Diagnosed Multiple Myeloma: Analysis of Mature Data from 7077 Patients Collected By European Myeloma Network within Harmony Big Data Platform. Retrieved 3 January 2021, from https://ash.confex.com/ash/2020/webprogram/Paper137021.html.


Lo sentimos, el formulario de comentarios está cerrado en este momento.