
MIELOMA MULTIPLE: TRATAMIENTO
El objetivo principal del tratamiento de los pacientes con mieloma múltiple es aumentar la supervivencia y la calidad de vida mitigando las complicaciones relacionadas con la enfermedad mediante la supresión de la malignidad a largo plazo. Las terapias suelen tener como objetivo reducir la cantidad de células plasmáticas malignas en la médula ósea, que se mide en parte por el nivel de la proteína monoclonal y las cadenas ligeras libres en suero.
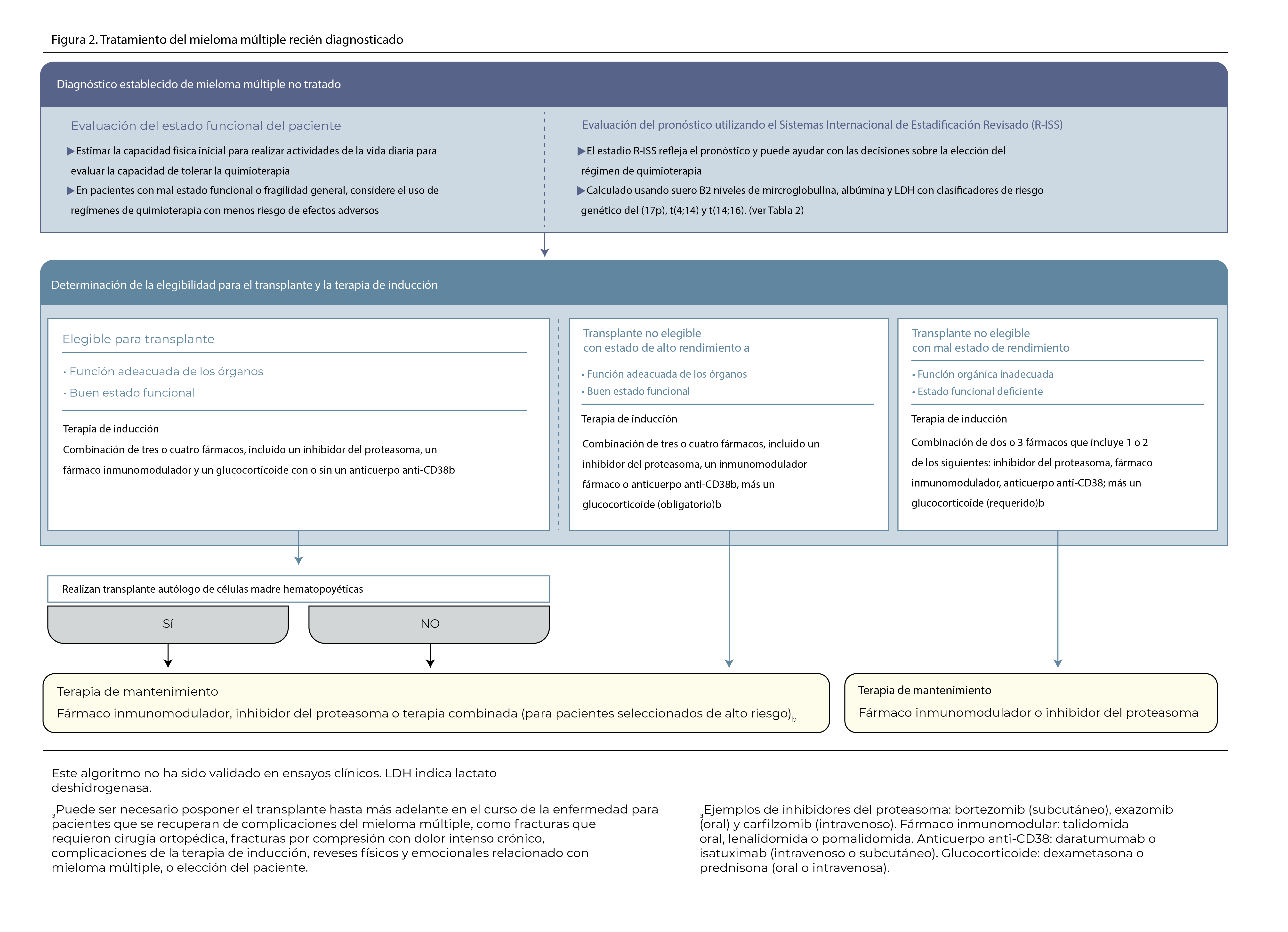
Una mayor reducción de estas células plasmáticas malignas se correlaciona con un control de la enfermedad. Los avances más significativos en la terapia del mieloma múltiple han sido la introducción de inhibidores del proteasoma (p. ej., bortezomib, ixazomib y carfilzomib), agentes inmunomoduladores (p. ej., talidomida, lenalidomida y pomalidomida), anticuerpos monoclonales dirigidos contra antígenos de la superficie celular del mieloma (p. ej., daratumumab, elotuzumab e isatuximab) y trasplante autólogo de células madre hematopoyéticas (Figura 2). Una vez que se confirma el diagnóstico de mieloma múltiple, se debe iniciar la terapia inicial (de inducción) y se debe evaluar la elegibilidad para el trasplante autólogo de células madre hematopoyéticas.
Los pacientes se consideran elegibles para el trasplante autólogo de células madre hematopoyéticas si tienen una función orgánica adecuada y un buen estado funcional. La edad avanzada no es una contraindicación para el trasplante, aunque la mayoría de los pacientes que se someten al procedimiento son menores de 70 a 75 años. Las enfermedades cardíacas, pulmonares o hepáticas significativas a menudo excluyen a los pacientes, pero el trasplante aún se puede realizar de manera segura en pacientes con insuficiencia renal.
Pacientes elegibles para trasplante
Terapia de inducción, consolidación y mantenimiento Los pacientes elegibles para trasplante generalmente reciben de 3 a 6 meses de terapia de inducción antes del trasplante. Aunque no es una práctica estándar, se puede administrar la consolidación, que se refiere a ciclos de tratamiento adicionales después del trasplante, y actualmente se encuentra en evaluación en ensayos clínicos. La terapia de mantenimiento se refiere a la terapia antimieloma en dosis bajas, con el objetivo de prolongar la remisión después de la terapia inicial. Actualmente, la terapia inicial estándar para pacientes elegibles para trasplante es RVd.
Un ensayo clínico del grupo cooperativo nacional de EE. UU. S0777 dirigido por el Southwest Oncology Group asignó al azar a 525 pacientes con mieloma múltiple recién diagnosticado a RVd o una terapia doble con lenalidomida + dexametasona (Rd). La supervivencia libre de progresión fue significativamente mejor en los asignados al azar a RVd, en comparación con Rd (41 meses en comparación con 29 meses). Con base en estos resultados y evidencia adicional de ensayos clínicos, RVd es el estándar actual de atención.
Recientemente, los resultados de los ensayos clínicos GRIFFIN y CASSIOPEIA han estudiado la combinación del anticuerpo anti-CD38, daratumumab, con regímenes de inhibidor del proteasoma + agente inmunomodulador + glucocorticoides para pacientes con mieloma múltiple recién diagnosticado. GRIFFIN asignó al azar a 207 pacientes en los EE. UU. con mieloma múltiple recién diagnosticado a daratumumab con RVd o RVd solo. El resultado primario de la tasa de respuesta completa al final de la consolidación después del trasplante fue significativamente mayor en el grupo de terapia combinada, en comparación con RVd solo (42,4 % frente a 32 %).
En el ensayo CASSIOPEIA, 1085 pacientes en Europa con mieloma múltiple recién diagnosticado fueron aleatorizados a daratumumab con bortezomib + talidomida + dexametasona (VTd) o a VTd solo antes y después trasplante. En una mediana de seguimiento de 18,8 meses, las tasas de respuesta completa fueron significativamente más altas en el grupo de daratumumab + VTd, en comparación con VTd solo]). Estos datos sugieren que la combinación de daratumumab con inhibidores del proteasoma, agentes inmunomoduladores y glucocorticoides como tratamiento inicial para el mieloma múltiple puede mejorar los resultados en pacientes elegibles para trasplante.
Las toxicidades primarias de los fármacos de la terapia de inducción incluyen neuropatía periférica (hasta el 33% de los pacientes tratados con RVd), reactivación de la varicela, eventos tromboembólicos venosos, neutropenia, infecciones y teratogenicidad con agentes inmunomoduladores. Los anticuerpos monoclonales se asocian con reacciones relacionadas con la infusión, que consisten en disnea, tos, escalofríos, sarpullido, rinitis alérgica, dolor de garganta y náuseas, generalmente con la primera dosis, en hasta el 45 % de los pacientes.
Trasplante autólogo de células madre hematopoyéticas para el mieloma múltiple
Para los pacientes que se someten a un trasplante de células madre, el factor estimulante de colonias, la quimioterapia (típicamente ciclofosfamida) o ambos se usan para estimular y movilizar las células madre de la sangre periférica, que se recolectan mediante aféresis. Después de la recolección de células madre, los pacientes reciben dosis altas de melfalán por vía intravenosa (un potente agente antimieloma), seguido de una reinfusión de células madre. El ensayo clínico Intergroupe Francophone du Myélome 2009 asignó al azar a 700 pacientes con mieloma múltiple recién diagnosticado tratados con inducción y consolidación de RVd para recibir trasplante o no recibir trasplante, seguido de lenalidomida de mantenimiento durante 1 año, a los 14 meses de seguimiento, la supervivencia libre de progresión fue significativamente mejor en las personas que recibieron el trasplante (50 meses frente a 36 meses).
Las tasas de mortalidad del trasplante son menores o iguales al 1%.
Los efectos adversos más comunes del trasplante incluyen mucositis, náuseas/ vómitos, anorexia y mielosupresión (asociados con un mayor riesgo de infección).. Hay un pequeño aumento en las neoplasias malignas secundarias, particularmente el síndrome mielodisplásico y la leucemia mieloide aguda, en pacientes que reciben terapia de mantenimiento a largo plazo con lenalidomida después del trasplante.93
El alotrasplante de células madre hematopoyéticas de intensidad reducida (el donante y el receptor no son la misma persona) utilizando células madre de donantes no se usa ampliamente para el tratamiento del mieloma múltiple, y los datos de los ensayos clínicos son contradictorios con respecto al beneficio. El trasplante alogénico de células madre hematopoyéticas para el mieloma múltiple se usa principalmente para pacientes más jóvenes (generalmente menores de 50 años) que tienen una enfermedad de alto riesgo y debe realizarse dentro de los ensayos clínicos siempre que sea posible.
Después del trasplante, el estándar de atención estándar es la terapia de mantenimiento (definida como la administración continua a largo plazo en dosis bajas de un agente antimieloma activo) con lenalidomida o bortezomib para prolongar la remisión. La terapia de mantenimiento con lenalidomida mejoró la supervivencia en un solo ensayo grande y se asoció con una mejor supervivencia en un metanálisis.

Mieloma múltiple no elegible para trasplante
Para los pacientes que no son aptos para el trasplante, el tratamiento recomendado consiste en regímenes combinados de 3 fármacos, como RVd, o daratumumab + lenalidomida + dexametasona, seguidos de mantenimiento con lenalidomida. El ensayo Southwest Oncology Group S0777 aleatorizó a 525 pacientes con mieloma múltiple para los que no se pretendía un trasplante inmediato; 264 fueron aleatorizados a RVd y 261 a Rd. El 43% de los pacientes tenían 65 años o más, 57 y estos pacientes recibieron dosis de terapia ajustadas por edad y condiciones médicas crónicas; RVd fue superior a Rd en pacientes mayores de 65 años. Los pacientes mayores que no pueden tolerar RVd pueden recibir terapia con lenalidomida o bortezomib combinado con un glucocorticoide como alternativa.
Respuesta al tratamiento
La respuesta a la terapia en el mieloma múltiple se mide mediante el control del hemograma completo, electroforesis en suero y orina, niveles de cadenas ligeras libres en suero, biopsia de médula ósea e imágenes. La desaparición de la proteína monoclonal y la mejora en los recuentos sanguíneos, la función renal y el dolor son indicativos de un tratamiento exitoso.
Enfermedad residual mínima en mieloma múltiple
Hay nuevas tecnologías disponibles para evaluar a los pacientes en busca de enfermedad residual mínima (es decir, niveles muy bajos de mieloma múltiple en la médula ósea después de la terapia). La secuenciación de próxima generación del gen de inmunoglobulina dentro de las células de mieloma permite la detección de células plasmáticas malignas presentes en 1 célula anormal por millón de células normales (10−6) y ahora está aprobado por la (FDA) para el mieloma múltiple. La enfermedad residual mínima evaluada mediante secuenciación de última generación se puede utilizar para predecir los resultados a largo plazo, y su posible aplicación en el tratamiento está en estudio (ClinicalTrials.gov NCT03901963 and NCT04071457).
Tratamiento del mieloma múltiple recidivante
Si no se recibió previamente, el tratamiento con daratumumab o isatuximab, ambos anticuerpos monoclonales anti-CD38, combinados con un esteroide y un fármaco inmunomodulador o un inhibidor del proteasoma, puede ser muy eficaz, con tasas de respuesta general del 60 % al 85 %. Carfilzomib, un inhibidor del proteasoma de segunda generación, se puede combinar con un agente inmunomodulador o un agente alquilante (ciclofosfamida). Elotuzumab, un anticuerpo monoclonal anti-SLAMF7 (antígeno de superficie CD319), es eficaz cuando se administra en combinación con dexametasona y lenalidomida o pomalidomida. Selinexor, un inhibidor de la exportina 1, fue aprobado en 2019 para tratar pacientes con mieloma múltiple recidivante. En 2020, la FDA aprobó belantamab mafodotin, un conjugado de anticuerpo monoclonal que se dirige a una proteína en la superficie de las células plasmáticas, el antígeno de maduración de células B. La quimioterapia citotóxica de agentes múltiples (p. ej., ciclofosfamida + doxorrubicina + cisplatino + etopósido [PACE], u otros regímenes similares) puede administrarse para el control de la enfermedad a corto plazo o como puente hacia terapias más duraderas en algunos pacientes con enfermedad rápidamente progresiva.
Se debe considerar el trasplante en el momento de la recaída de la enfermedad en pacientes con células madre autólogas almacenadas que han logrado una remisión duradera desde su primer trasplante; los pacientes que pospusieron el trasplante en el momento del diagnóstico deben ser considerados seriamente para este procedimiento en la primera recaída.
En abril de 2021, se aprobó la primera terapia de células T con receptor de antígeno quimérico (CAR) dirigida al antígeno de maduración superficial de células B para el mieloma múltiple, idecaptagene vicleucel (Ide-cel/Abecma). probado por la FDA para pacientes con mieloma múltiple en recaída. En la terapia de células T con CAR, las células T se recolectan del torrente sanguíneo de un paciente y luego se modifican genéticamente para atacar una proteína de superficie en la membrana de la célula de mieloma. Luego, las células CAR T diseñadas se administran nuevamente al paciente después de la quimioterapia inmunosupresora. Nuevos derivados de fármacos inmunomoduladores, conocidos como moduladores de ligasa E3 de cereblon (CELMoD), se han probado en estudios de fase temprana y han mostrado evidencia temprana de eficacia y seguridad en mieloma múltiple recidivante y refractario.
Atención de apoyo para el mieloma múltiple
Salud ósea: Los pacientes con mieloma múltiple tienen un riesgo del 40 % al 50 % de desarrollar fracturas o dolor óseo que requiera paliación. En ensayos clínicos aleatorizados, los bisfosfonatos y los inhibidores del ligando del activador del receptor del factor nuclear kappa-B redujeron el riesgo de eventos relacionados con el esqueleto en pacientes con mieloma múltiple. Para los pacientes con fracturas patológicas, puede ser necesaria la vertebroplastia o la fijación con clavos intramedulares para mejorar el dolor y el estado funcional.
Infecciones: Los pacientes con mieloma múltiple tienen una mayor tasa de infecciones, debido a la inmunodeficiencia relacionada con el mieloma (disfunción de células B y células T) y al uso rutinario de tratamientos inmunosupresores. Se deben recetar medicamentos antivirales como aciclovir y valaciclovir para prevenir la reactivación de la varicela zóster y el herpes zóster en pacientes que reciben inhibidores del proteosoma como bortezomib, carfilzomib e ixazomib; anti-CD38; o terapia con anticuerpos monoclonales anti-SLAM7, como daratumumab, isatuximab y elotuzumab. En pacientes seleccionados, como aquellos con múltiples comorbilidades, se debe considerar la profilaxis antibiótica con levofloxacina para prevenir infecciones bacterianas.112 Los factores de crecimiento como el filgrastim y la eritropoyetina suelen ser necesarios para tratar la neutropenia y la anemia relacionadas con el tratamiento.
Eventos tromboembólicos venosos: Los pacientes con mieloma múltiple tienen un mayor riesgo de tromboembolismo venoso y arterial, particularmente cuando reciben fármacos inmunomoduladores como talidomida, lenalidomida o pomalidomida. Se recomienda la profilaxis tromboembólica con aspirina, heparina de bajo peso molecular o un anticoagulante oral de acción directa para todos los pacientes con mieloma múltiple que reciben un fármaco inmunomodulador según el riesgo subyacente.
Radiación paliativa: Para los pacientes con lesiones líticas o extramedulares dolorosas, se puede considerar un curso breve de radioterapia del campo afectado para paliar los síntomas. Oncología radioterápica internacional para el linfoma Las pautas grupales sobre radioterapia recomiendan dosis de 8 Gy en 1 fracción, 20 Gy en 5 fracciones o 20 a 30 Gy entre 10 y 20 fracciones, para la paliación de lesiones óseas de mieloma dolorosas o plasmacitomas.
Bibliografía:
Cowan A. Diagnosis and Management of Multiple Myeloma A Review JAMA. 2022; 327(5): 464-477. doi:10.1001/jama.2022.0003

Lo sentimos, el formulario de comentarios está cerrado en este momento.