
CALIDAD DE LOS MEDICAMENTOS
Si realizamos una búsqueda de los términos: “cancer”, “drugs” y “quality”, Pubmed nos devuelve 9447 resultados; en el año 1972 apenas hay un artículo publicado mientras que en el año 2020 951 referencias se encuentran lo que muestra el interés creciente en esta temática1.
La presencia de drogas de baja calidad se ha convertido en un problema importante para el mundo con énfasis en países en vías de desarrollo, este es un problema que no debería ser ignorado por la sociedad2. El problema radica no solamente en la entrega de productos de baja calidad sino en su posterior trazabilidad para recuperarlos efectivamente; el ejemplo de Darfur clarifica este rompecabezas, en octubre del 2004 se encontró que una donación de lactato de Ringer presentaba contaminación por hongos, a pesar del alto riesgo de problemas al ser una solución para utilización por vía intravenosa en un lapso de 6 meses apenas un 15% (2200 de 15000 unidades) habían sido localizadas2.
Los dilemas relacionados a drogas de baja calidad a lo largo del tiempo se han visto asociados a diversos problemas como:
a) toxicidad fatal, como el caso de la contaminación de formulaciones de paracetamol en jarabe contaminadas con dietilenglicol en Haití asociadas con 109 casos de insuficiencia renal en niños de los que el 80,7% murieron3;
b) problemas con la respuesta al tratamiento como el caso de muertes por falta de respuesta del paludismo ante tratamientos de mefloquine de pobre calidad en Asia4;
c) y finalmente otro de los puntos de gran impacto de medicamentos de baja calidad ha sido el desarrollo de resistencia por las enfermedades, se cita el caso de medicamentos contra la tuberculosis que podrían contener un 85% de principio activo inclusive que podría ser el equivalente a retrasar o suspender el tratamiento5.
¿A qué podemos considerar como una droga de baja calidad?
La Organización Mundial de la Salud indica como drogas de baja calidad: “Los medicamentos de calidad inferior son productos farmacéuticos genuinos … que no cumplen con las especificaciones de calidad establecidas para ellos por los estándares nacionales”6.
La Farmacopea de Estados Unidos de Norteamérica los define cómo: Producto genérico o de marca legal, pero que no cumple con los estándares internacionales de calidad, pureza, resistencia o empaque.
Varias razones confluyen para esto, inclusive se ha observado que fabricantes que ofrecen calidad en sus productos para mercados de primer mundo pueden relajar sus medidas de calidad para los productos que se distribuyen en países con menores controles2; otra razón de importancia es la limitación en la capacidad técnica para evaluaciones, la Organización Mundial de la Salud estima que solamente seis países tienen sistemas regulatorios completos para evaluación de drogas que incluyan inspecciones de campo de los fabricantes entre otras7, otro problema de gran influencia es la incipiente capacidad de los países en desarrollo para la implementación de sistemas eficaces de farmacovigilancia, sobre todo por la falta de recursos para los programas de seguimiento post-registro8. Para dimensionar estas situaciones, en el siguiente gráfico mostramos el porcentaje de hallazgos de calidad identificados en diversos medicamentos, el gráfico no busca igualar los criterios, más, su finalidad es mostrar la dimensión del asunto.
Gráfico 1: Porcentaje de problemas de calidad versus total de drogas comercializadas en distintos países e indicaciones.
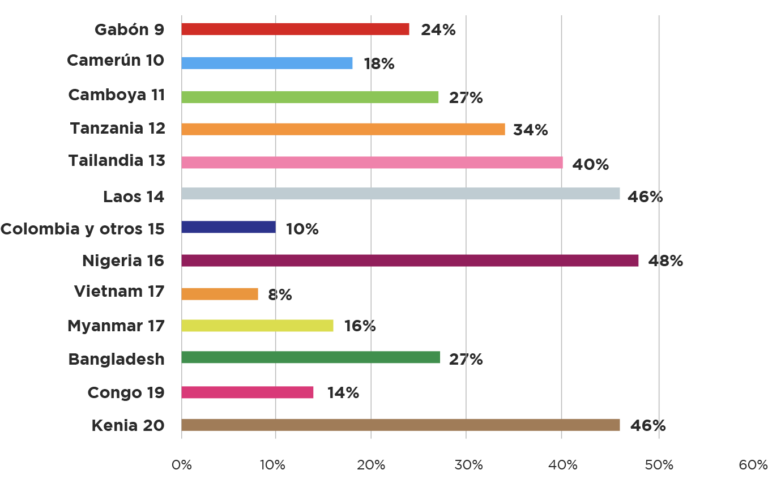
Lo anterior muestra que los temas de calidad baja en medicamentos en forma general no son un tema aislado y que además no han sido visibilizados por la comunidad en general.
¿Cómo afecta la calidad en los tratamientos oncológicos?
Por otra parte el cáncer, si bien es una enfermedad que conlleva alta expectativa de mortalidad, con el avance de la ciencia ha experimentado cambios gigantescos. Si revisamos a nivel internacional como ha cambiado la supervivencia de los 10 tumores malignos más frecuentes en Ecuador encontramos un incremento entre la gran mayoría de tumores:
Gráfico 2: Incremento de supervivencia entre los períodos 1970-1977 y 2007-2013, organizados de acuerdo a los 10 primeros tumores malignos del Ecuador21,22.
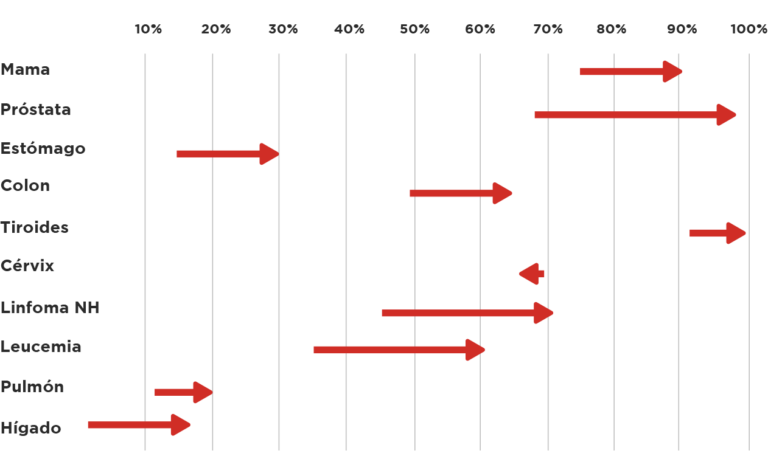
Hay incremento de la supervivencia de los pacientes; este incremento está asociado a mejores terapias de soporte, tratamientos quirúrgicos, radioterapia así como la mejoría de los tratamientos disponibles. Para lograr este incremento, un increíble esfuerzo de instituciones, la creación de redes de ciencia así como el incremento en las publicaciones científicas se han volcado para demostrar eficacia, pero también han sido importantes las contribuciones para definir la seguridad de los nuevos tratamientos23.
En cáncer de próstata con el advenimiento de nuevas terapias se ha logrado también un impacto favorable en la supervivencia, en el Reino Unido por ejemplo se encontró que desde el periodo 1971-1972 se tuvo una supervivencia del 65,9% a un año hasta un 94% en el año 2010-201124.
Este incremento en la supervivencia se ha producido antes del lanzamiento de una serie de nuevas terapias que han incrementado sustantivamente los buenos resultados de las terapias. Recordamos el gran impacto que a mediados de los años 2000 causó la publicación de Tannock, en la que se demostraba el beneficio en Supervivencia global de un tratamiento en el escenario del cáncer de próstata resistente a la castración metastásico (aunque en ese tiempo se hablaba de cáncer hormono-refractario); hubo beneficio en comparación de mitoxantrone tanto en Supervivencia global como en Supervivencia libre de progresión, se alcanzaron los 18,9 meses en global25. Se ha alcanzado supervivencias de 12,7 meses con cabazitaxel26, 15,8 meses con abiraterona27, 18,4 meses con enzalutamida28 luego de haber utilizado docetaxel.
Posteriormente, el desafío del incremento de supervivencia del cáncer de próstata resistente a la castración metastásico establecido en 18,9 meses ha sido desafiado por las supervivencias alcanzadas en dicho escenario tanto por abiraterona con supervivencia que llegó a los 34,7 meses en el análisis extendido29 así como con enzalutamida que logro una supervivencia media de 32,4 meses30 de incremento en las publicación inicial y que llegó a los 35,3 meses de supervivencia global en el análisis extendido31.
El horizonte se ha ampliado con la innovación de los tratamientos en los escenarios de cáncer de próstata resistente a la castración que incluyen ahora al escenario sin metástasis, además de tratamiento en metastásico hormono-sensible y las investigaciones futuras que lograrán sumar mas tiempo a los pacientes en lo referente a supervivencia global supervivencia libre de progresión, calidad de vida y seguridad32.
Estas mejorías se han logrado gracias a la investigación constante y a la innovación terapéutica, y un problema que afronta el transpolar los resultados a la práctica cotidiana incluyen las dificultades para accesos a tratamientos que lamentablemente tienen asociación con el nivel de desarrollo de los países33.
Se ha encontrado que en el caso de cáncer hay también evidencia de medicamentos de baja calidad. Por ejemplo, en Etiopía se revisaron 20 muestras de cisplatino de diversos orígenes que se utilizaban en forma corriente en dicho país. Al revisarlos ninguno de ellos era un medicamento con calidad óptima, de hecho en promedio todas las formulaciones contenían un 54% (+/- 6%) del platino que se indicaba en el etiquetado y la formulación que más contenía apelas llegaba al 71% de lo que indicaba la etiqueta; en cáncer no tenemos tantas publicaciones como es el caso de otras enfermedades34; sin embargo, dado que en ambientes en que las autoridades regulatorias enfrentan grandes dificultades para controles hay alta probabilidad de circulación de productos de baja calidad en diversas moléculas, es muy probable que en cáncer también tengamos este problema.
El artículo de prensa de Nieves nos orienta a identificar problemas con pacientes secundarios a la baja calidad35 . Y la revisión de Kaltenboeck nos muestra dificultad al momento de comparar con exhaustividad el impacto de imatinib versus el original, aunque hay elementos que muestran inferioridad, en la investigación se concluye que el atractivo del precio visto por los pagadores podría tenerse pero con bioequivalencia incierta y que inclusive los criterios para establecer dicha bioequivalencia así como el seguimiento posterior en algunos países es insuficiente y no podría garantizar la provisión de medicamentos de calidad y por ende hay la posibilidad de serios problemas clínicos36.
“La garantía de calidad comprende una serie de procesos destinados a asegurar que los consumidores finales reciban un producto que cumpla con los estándares y especificaciones de calidad, seguridad y eficacia”. (Política Nacional de Medicamentos, página 17).
La situación regional de la calidad
En Hispanoamérica como en otras partes del mundo la calidad de los medicamentos ha sido un tema de preocupación; sin embargo, podría quedar solamente en la preocupación. En el año 2020 Robin Rojas-Cortés evaluó los problemas relacionados con la región en cuanto a problemas de calidad, es llamativo que un alto porcentaje se debe a medicamentos subestándar, lo encontrado en la investigación lo presentamos a continuación37:
Gráfico 3: Problemas encontrados en medicamentos comercializados en Hispanoamérica relacionados a calidad, falsificación u otros.
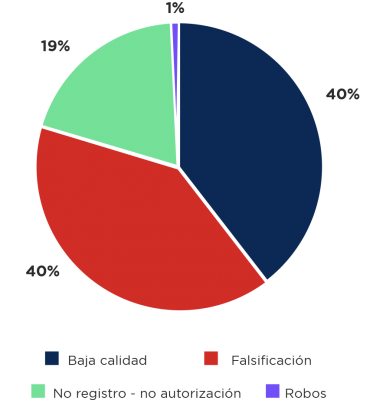
Es llamativo el alto porcentaje de problemas de baja calidad en Hispanoamérica. Si observamos con detenimiento, es un problema de la misma severidad que la falsificación de medicamentos que suele tener mayor visualización. En el estudio se comparan los problemas detectados por agencias de referencia versus otras, se encuentra que el porcentaje de hallazgos en las primeras abarca el 57,6% de los hallazgos (en las agencias de no referencia solamente Perú despunta al contribuir con la investigación del 72,7% de incidentes en este grupo de agencias).
Un tema dramático, es que los problemas de medicamentos con calidad subestándar son detectados en el 90,68% en las agencias de referencia, esto implica los problemas que las otras agencias entre las que se encuentra nuestro país tienen a la hora de realizar evaluaciones, y de las agencias de referencia que corresponden a Argentina, Brasil, Chile, Colombia, Cuba y México; Brasil tiene el 51,4% de los hallazgos que además de la población también puede ser por el mayor control de su agencia regulatoria37.
Por otra parte, en Ecuador en dicho estudio se han encontrado 16 incidentes, la mitad correspondió a medicamentos no registrados y el 25% a medicamentos con baja calidad37. El problema de esto es que corresponde a hallazgos denunciados e investigados, no tenemos certeza de cuántos problemas potenciales tendremos en nuestra región y en nuestro territorio.
La calidad es un elemento considerado en nuestra normativa en lo referente a la atención de salud; sin embargo, también es un problema de gran importancia en la práctica diaria; las asociaciones médicas han presentado quejas respecto a la posible baja calidad de medicamentos38. Han sido de conocimiento público varias denuncias sobre medicamentos aunque no tenemos una línea sistemática de investigación en nuestra nación.
Con base en todo lo comentado, consideramos importante el abordar la calidad de los tratamientos, en especial en el ámbito de la Oncología ya que un tratamiento con calidad aproxima los resultados publicados en la evidencia y en el caso contrario de no contar con dicha calidad la incertidumbre se cierne en nuestros pacientes en lo referente a falta potencial de respuestas y problemas de seguridad.
Bibliografía
- 2021. cancer drugs quality – Search Results – PubMed. [online] Available at: <https://pubmed.ncbi.nlm.nih.gov/?term=cancer+drugs+quality&sort=date&size=200> [Accessed 25 May 2021].
- Caudron, J., Ford, N., Henkens, M., Macé, C., Kiddle-Monroe, R. and Pinel, J., 2008. Substandard medicines in resource-poor settings: a problem that can no longer be ignored. Tropical Medicine & International Health, 13(8), pp.1062-1072.
- O’Brien, K., 1998. Epidemic of Pediatric Deaths From Acute Renal Failure Caused by Diethylene Glycol Poisoning. JAMA, 279(15), p.1175.
- Aldhous, P., 2005. Murder by medicine. Nature, 434(7030), pp.132-134.
- Moses, O., 2013. Substandard rifampicin based anti-tuberculosis drugs common in Ugandan drug market. African Journal of Pharmacy and Pharmacology, 7(34), pp.2428-2437.
- int. 2021. [online] Available at: <https://www.who.int/medicines/services/counterfeit/faqs/QACounterfeit-October2009.pdf> [Accessed 25 May 2021].
- who.int. 2021. [online] Available at: <https://apps.who.int/iris/bitstream/handle/10665/84307/WHO_EDM_2004.5_eng.pdf;jsessionid=B57E591912F62E4F7A3FA934E3505537?sequence=1> [Accessed 25 May 2021].
- int. 2021. [online] Available at: <https://www.who.int/medicines/publications/ReportWHOconsultationNov06.pdf> [Accessed 25 May 2021].
- Maponga C & Ondari C (2003) The Quality of Antimalarials. AStudy in Selected African Countries. WHO, Geneva.
- ReMeD (1995) La Qualite´des me´dicaments sur le marche´phar-maceutique africain: e´tude analytique dans trois pays: Cameroun, Madgascar, Tchad. Action Programme on EssentialDrugs. WHO, Geneva.
- Lon CT, Tsuyuoka R, Phanouvong S et al. (2006) Counterfeit and substandard antimalarial drugs in Cambodia. Transactions of the Royal Society of Tropical Medicine and Hygiene 100, 1019–1024.
- Minzi OM, Moshi MJ, Hipolite D et al. (2003) Evaluation of the quality of amodiaquine and sulphadoxine ⁄ pyrimethamine tablets sold by private wholesale pharmacies in Dar Es Salaam Tanzania. Journal of Clinical and Pharmacological Therapy 28,117–122.
- Shakoor O, Taylor RB & Behrens RH (1997) Assessment of the incidence of substandard drugs in developing countries. Tropical Medicine and International Health2, 839–845.
- Stenson B, Lindgren BH, Syhakhang L & Tomson G (1998) The quality of drugs in private pharmacies in the Lao People’s Democratic Republic. International Journal of Risk and Safety in Medicine 11, 243–249.
- Laserson KF, Kenyon AS, Kenyon TA, Layloff T & Binkin NJ(2001) Substandard tuberculosis drugs on the global market and their simple detection. International Journal of Tubercle and Lung Disease 5, 448–454.
- Taylor RB, Shakoor O, Behrens RH et al. (2001) Pharmacopoeia l quality of drugs supplied by Nigerian pharmacies. Lancet 357,1933–1936.
- Wondemagegnehu E (1999) Counterfeit and Substandard Drugs in Myanmar and Viet Nam. WHO, Geneva.
- Roy J (1994) The menace of substandard drugs. World Health Forum 15, 406–407.
- Atemnkeng MA, De Cock K & Plaizier-Vercammen J (2007) Quality control of active ingredients in artemisinin-derivative antimalarials within Kenya and DR Congo. Tropical Medicine and International Health 12, 68–74.
- Kibwage IO, Otego JO, Maitai CK, Rutere G, Thuranira J &Ochieng A (1992) Drug quality control work in Daru: observations during 1983-6. East African Medical Journal 69, 577–580.
- iarc.fr. 2021. [online] Available at: <https://gco.iarc.fr/today/data/factsheets/populations/218-ecuador-fact-sheets.pdf> [Accessed 26 May 2021].
- Ritchie, H., 2018. Cancer death rates are falling; five-year survival rates are rising. [online] Our World in Data. Available at: <https://ourworldindata.org/cancer-death-rates-are-falling-five-year-survival-rates-are-rising> [Accessed 26 May 2021].
- Armando, R., Mengual Gómez, D. and Gomez, D., 2020. New drugs are not enough‑drug repositioning in oncology: An update. International Journal of Oncology.
- Cancer Research UK. 2021. Prostate cancer survival statistics. [online] Available at: <https://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/prostate-cancer/survival#heading-Two> [Accessed 26 May 2021].
- Tannock, I., de Wit, R., Berry, W., Horti, J., Pluzanska, A., Chi, K., Oudard, S., Théodore, C., James, N., Turesson, I., Rosenthal, M. and Eisenberger, M., 2004. Docetaxel plus Prednisone or Mitoxantrone plus Prednisone for Advanced Prostate Cancer. New England Journal of Medicine, 351(15), pp.1502-1512.
- Oudard, S., 2011. TROPIC: Phase III trial of cabazitaxel for the treatment of metastatic castration-resistant prostate cancer. Future Oncology, 7(4), pp.497-506.
- Fizazi, K., Scher, H., Molina, A., Logothetis, C., Chi, K., Jones, R., Staffurth, J., North, S., Vogelzang, N., Saad, F., Mainwaring, P., Harland, S., Goodman, O., Sternberg, C., Li, J., Kheoh, T., Haqq, C. and de Bono, J., 2012. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. The Lancet Oncology, 13(10), pp.983-992.
- Scher, H., Fizazi, K., Saad, F., Taplin, M., Sternberg, C., Miller, K., de Wit, R., Mulders, P., Chi, K., Shore, N., Armstrong, A., Flaig, T., Fléchon, A., Mainwaring, P., Fleming, M., Hainsworth, J., Hirmand, M., Selby, B., Seely, L. and de Bono, J., 2012. Increased Survival with Enzalutamide in Prostate Cancer after Chemotherapy. New England Journal of Medicine, 367(13), pp.1187-1197.
- Ryan, C., Smith, M., Fizazi, K., Saad, F., Mulders, P., Sternberg, C., Miller, K., Logothetis, C., Shore, N., Small, E., Carles, J., Flaig, T., Taplin, M., Higano, C., de Souza, P., de Bono, J., Griffin, T., De Porre, P., Yu, M., Park, Y., Li, J., Kheoh, T., Naini, V., Molina, A. and Rathkopf, D., 2015. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. The Lancet Oncology, 16(2), pp.152-160.
- Beer, T., Armstrong, A., Rathkopf, D., Loriot, Y., Sternberg, C., Higano, C., Iversen, P., Bhattacharya, S., Carles, J., Chowdhury, S., Davis, I., de Bono, J., Evans, C., Fizazi, K., Joshua, A., Kim, C., Kimura, G., Mainwaring, P., Mansbach, H., Miller, K., Noonberg, S., Perabo, F., Phung, D., Saad, F., Scher, H., Taplin, M., Venner, P. and Tombal, B., 2014. Enzalutamide in Metastatic Prostate Cancer before Chemotherapy. New England Journal of Medicine, 371(5), pp.424-433.
- Beer, T., Armstrong, A., Rathkopf, D., Loriot, Y., Sternberg, C., Higano, C., Iversen, P., Evans, C., Kim, C., Kimura, G., Miller, K., Saad, F., Bjartell, A., Borre, M., Mulders, P., Tammela, T., Parli, T., Sari, S., van Os, S., Theeuwes, A. and Tombal, B., 2017. Enzalutamide in Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. European Urology, 71(2), pp.151-154.
- Kvízová, J., Pavlíčková, V., Kmoníčková, E., Ruml, T. and Rimpelová, S., 2021. Quo Vadis Advanced Prostate Cancer Therapy? Novel Treatment Perspectives and Possible Future Directions. Molecules, 26(8), p.2228.
- Hu, Q., 2013. Human development index is associated with mortality-to-incidence ratios of gastrointestinal cancers. World Journal of Gastroenterology, 19(32), p.5261.
- Eberle, M., Ashenef, A., Gerba, H., Loehrer, P. and Lieberman, M., 2020. Substandard Cisplatin Found While Screening the Quality of Anticancer Drugs From Addis Ababa, Ethiopia. JCO Global Oncology, (6), pp.407-413.
- Nieves, D., Rotshchild, S. and Scherzer, N., 2021. [online] Liferaftgroup.org. Available at: <https://liferaftgroup.org/wp-content/uploads/2013/03/AlianzaGIST.pdf> [Accessed 26 May 2021].
- Kaltenboeck, A., Long, G., Hayes-Larson, E. and Lopes, G., 2013. Assessing the impact of substandard copy medicines in developing countries: the experience with imatinib copies. Expert Review of Clinical Pharmacology, 6(6), pp.691-701.
- Rojas-Cortés, R., 2020. Substandard, falsified and unregistered medicines in Latin America, 2017-2018. Revista Panamericana de Salud Pública, 44, p.1.
- https://www.edicionmedica.ec/secciones/salud-publica/m-dicos-advierten-mala-calidad-de-medicamentos–88221


Lo sentimos, el formulario de comentarios está cerrado en este momento.