MIELOMA MULTIPLE: DIAGNÓSTICO Y PRONÓSTICO
Los hallazgos clínicos típicos incluyen anemia (definida como un nivel de hemoglobina <12 g/dL) en el 73 %, anormalidades (típicamente lesiones líticas) en radiografías convencionales en el 79 % y nivel elevado de creatinina sérica en 19%. Las características adicionales incluyeron hipercalcemia (13 %), linfadenopatía (1 %), leucopenia (20 %) y trombocitopenia (5 %).
En los pacientes recién diagnosticados con mieloma múltiple, aproximadamente el 3,3 % presentan enfermedad extramedular (definida como la presencia de uno o más plasmocitomas extraóseos en imágenes transversales), afectación del sistema nervioso central o leucemia de células plasmáticas. La enfermedad extramedular se asocia con un curso de la enfermedad más agresivo, tanto en el momento del diagnóstico como entre los pacientes con mieloma múltiple recidivante. La afectación del sistema nervioso central generalmente se presenta como enfermedad leptomeníngea o afectación de los nervios craneales. El tratamiento consiste en la administración de quimioterapia intratecal con citarabina, metotrexato o ambos, y la supervivencia suele ser corta (aproximadamente 7 meses).
Aproximadamente del 10% al 15% de los pacientes con mieloma múltiple son diagnosticados con amiloidosis de cadena ligera de inmunoglobulina concurrente durante el curso de su enfermedad.. La amiloidosis de cadena ligera se caracteriza por el depósito de cadenas ligeras mal plegadas (amiloide) en órganos vitales con deterioro de la capacidad debido a una miocardiopatía o nefropatía amiloide es una complicación bien conocida de la amiloidosis de cadena ligera.
Se debe considerar la amiloidosis de cadena ligera en pacientes con mieloma múltiple que tienen proteinuria en rango nefrótico, macroglosia, equimosis periorbitaria, agrandamiento de la glándula submandibular o miocardiopatía inexplicable. En pacientes con mieloma múltiple que tienen estas características, tanto la médula ósea como una biopsia de la almohadilla de grasa abdominal deben teñirse con rojo Congo para buscar amiloide.
Diagnóstico – Evaluación de laboratorio en mieloma múltiple
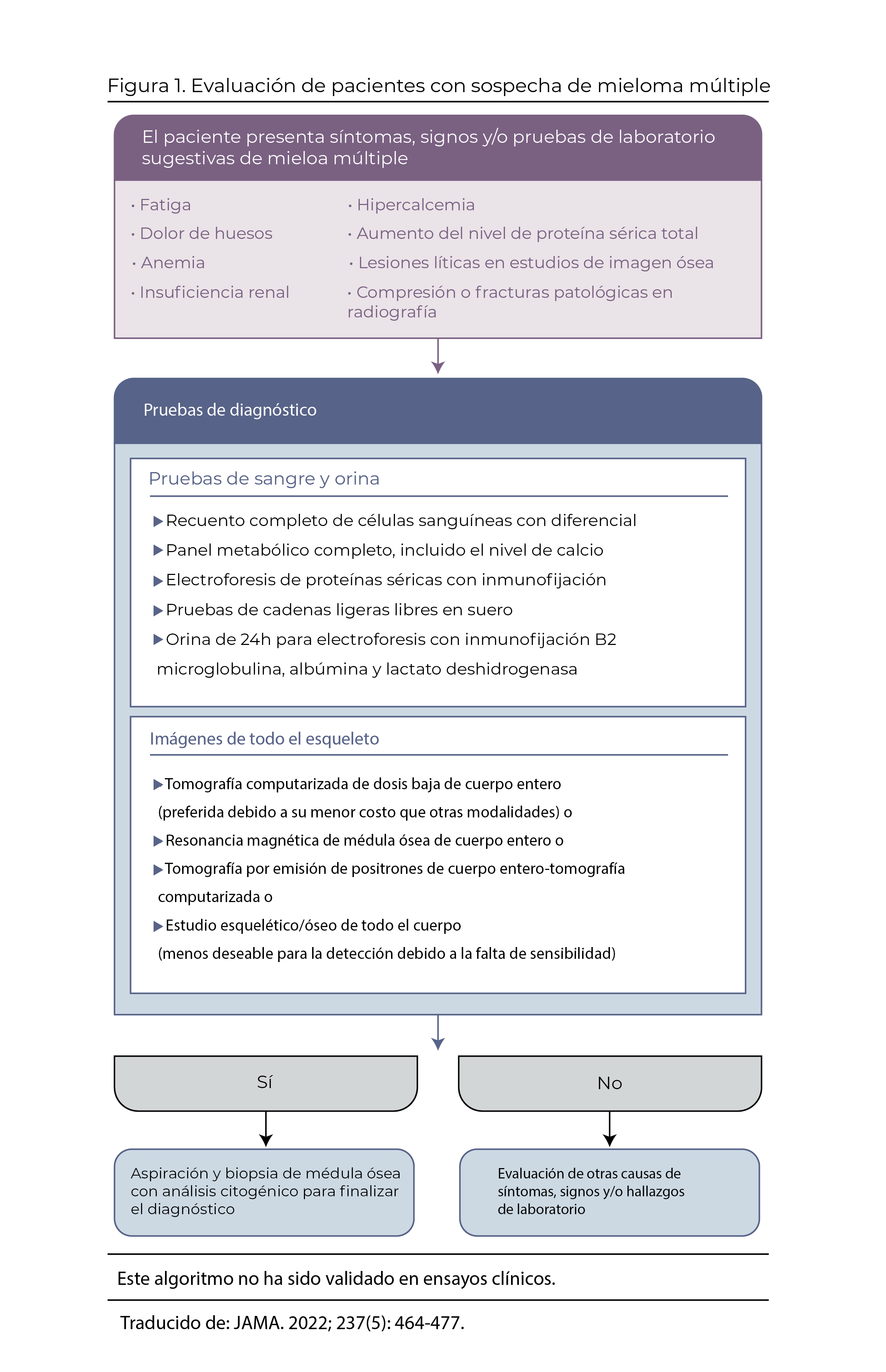
La evaluación de laboratorio inicial para el mieloma múltiple debe incluir un hemograma completo con diferencial; medición de creatinina sérica, calcio sérico, albúmina, lactato deshidrogenasa, cadenas ligeras libres séricas y β2niveles de microglobulina; y electroforesis de proteínas en suero y orina de 24 horas con inmunofijación (Figura 1).En aproximadamente el 86 % de las personas con mieloma múltiple, la electroforesis de proteínas séricas revela una proteína monoclonal, definida como la presencia de un anticuerpo atípico en la sangre.
Una prueba de proteína en orina de 24 horas para cuantificar la proteína de Bence-Jones es importante para documentar la presencia de proteinuria basal y evaluar la evidencia de amiloidosis de cadena ligera secundaria, que a menudo se manifiesta como proteinuria en rango nefrótico. El análisis de cadenas ligeras libres en suero debe realizarse porque cuantifica los niveles de cadenas ligeras libres kappa y lambda que pueden estar elevados y que contribuyen al daño de los órganos diana.
Las cadenas ligeras libres de proteína y suero al inicio son importantes para evaluar la extensión de la enfermedad al inicio y la respuesta a la terapia. El control de los niveles de proteína monoclonal y cadena ligera libre a lo largo del tiempo determinará si la terapia es exitosa. Aproximadamente del 1% al 2% de los pacientes presentan ausencia de marcadores medibles en suero u orina, lo que se denomina mieloma múltiple “no secretor”. Se debe considerar la citometría de flujo para identificar células plasmáticas circulantes anormales si la leucemia de células plasmáticas es un posible diagnóstico. Se debe realizar un aspirado de médula ósea unilateral y una biopsia en todos los pacientes con sospecha de mieloma múltiple; el análisis de la médula incluye la morfología de las células plasmáticas; cuantificación de células plasmáticas CD138+ en la biopsia central mediante inmunohistoquímica, citometría de flujo, hibridación fluorescente in situ (FISH) y citogenética convencional.
Adicionalmente, en todos los diagnósticos nuevos de mieloma múltiple, se debe realizar una tomografía computarizada (TAC) de todo el cuerpo inicial, una resonancia magnética nuclear (RMN) de todo el cuerpo o una tomografía computarizada por emisión de positrones de todo el cuerpo (PET-CT). Las imágenes pueden documentar fracturas por compresión, lesiones líticas o fracturas patológicas.
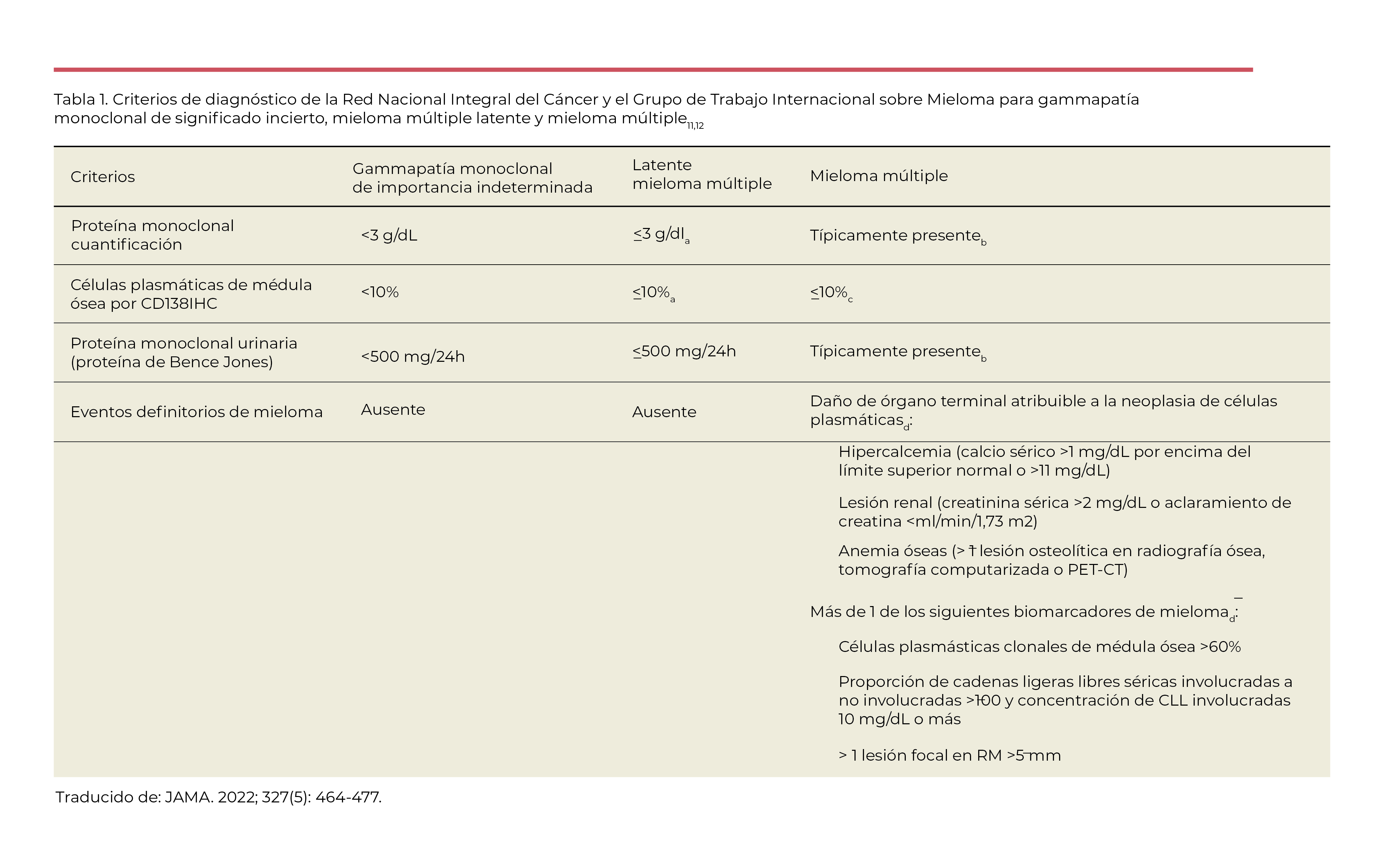
En 2014, el International Myeloma Working Group amplió los criterios para diagnosticar el mieloma múltiple activo o sintomático que requiere tratamiento: “biomarcadores que definen el mieloma”. Por lo tanto, un diagnóstico de mieloma múltiple se confirma en pacientes con 10% o más de células plasmáticas anormales en la médula ósea y al menos 1 de los eventos en órganos diana (criterios CRAB) o biomarcadores que definen el mieloma que se muestran en la Tabla 1.
Pronóstico – Sobrevivencia promedio
En pacientes con mieloma múltiple, los biomarcadores séricos de la carga de la enfermedad y los factores de riesgo genéticos se combinan en un algoritmo, el Sistema Internacional de Estadificación Revisado, para estimar el pronóstico (Cuadro 2).
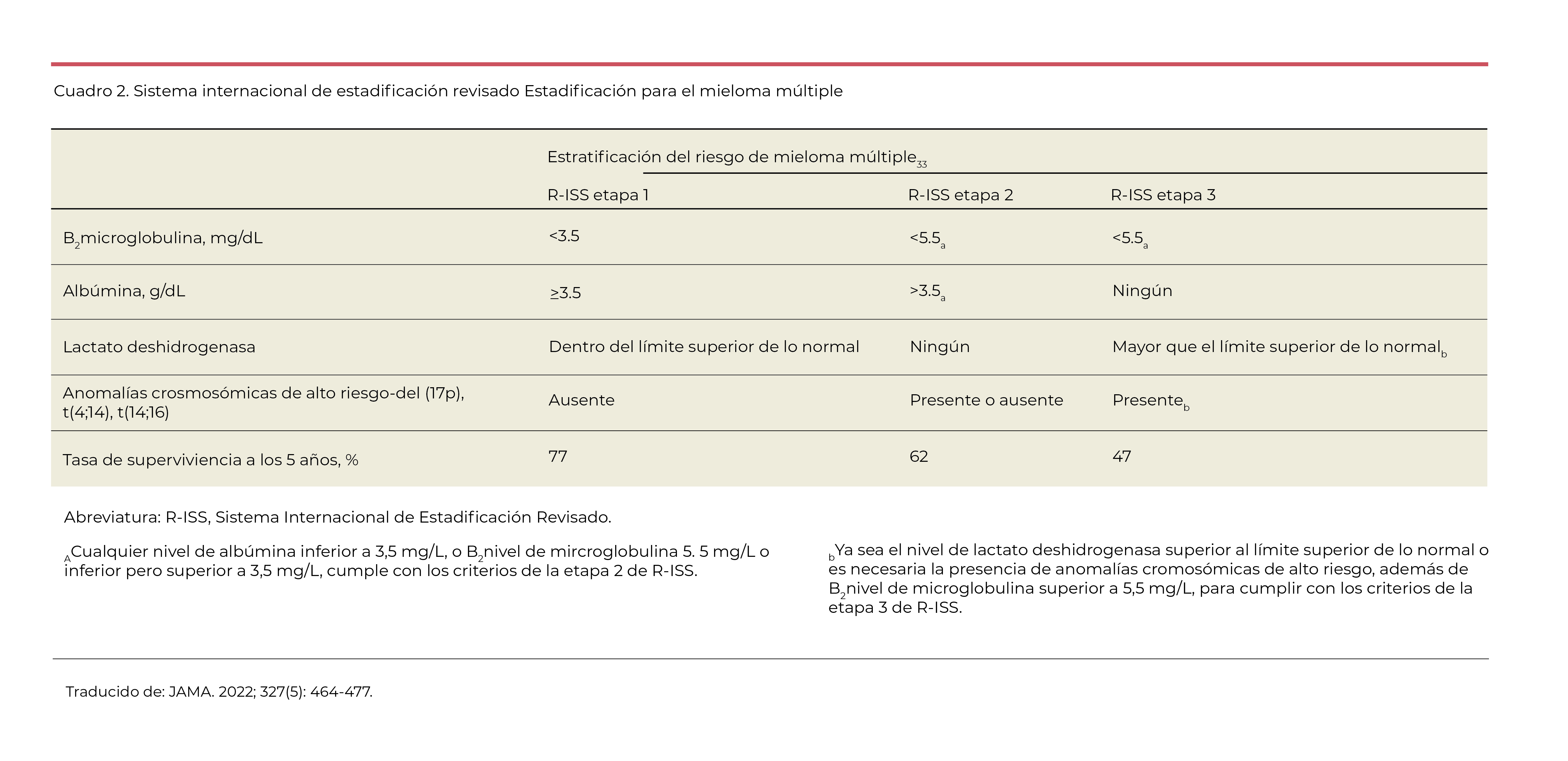
Estratificación del riesgo genético del mieloma múltiple
En pacientes con mieloma múltiple, el análisis genético de la célula plasmática maligna se puede realizar mediante FISH, en el que las sondas fluorescentes se unen a los cambios cromosómicos de interés en la célula de mieloma, identificando así los factores genéticos para estratificar el riesgo de los pacientes.
Las limitaciones incluyen la variabilidad de los umbrales de diagnóstico entre diferentes laboratorios y la falta de estandarización de los paneles FISH utilizados para el mieloma múltiple. La citogenética convencional (cariotipo) se realiza de manera rutinaria, pero carece de sensibilidad para detectar de manera rutinaria anormalidades cromosómicas relevantes en el mieloma múltiple.
Los siguientes hallazgos de FISH en el momento del diagnóstico se asocian con peor supervivencia libre de progresión y supervivencia general en el mieloma múltiple (también denominados cambios cromosómicos de alto riesgo): 1q+, t(4;14), t(14;16), t( 14;20), y del(17p) (mutación TP53). La presencia de múltiples características de alto riesgo, como la combinación del(17p) y 1q+, confiere un riesgo adicional. El cambio t(4;14) da como resultado una sobreexpresión del receptor 3 del factor de crecimiento de fibroblastos (FGFR3), ocurre en aproximadamente el 7% al 8% de los pacientes recién diagnosticados con mieloma múltiple, y se asocia con peor supervivencia libre de progresión y global. Del(17p) se debe a la perdida de p53, un gen supresor de tumores, en el brazo largo del cromosoma 17. Del(17p) ocurre en 5% a 20% de los pacientes y se asocia con peores resultados en pacientes con mieloma múltiple. Otros cambios, como t(14;16), dan como resultado una sobreexpresión delc-MAF se concentran en oncogenes y se identifican en el 3% al 5% de los pacientes con diagnóstico reciente de mieloma múltiple.

En pacientes con mieloma múltiple en recaída, pueden surgir nuevos hallazgos de FISH, lo que sugiere una evolución clonal, definida como la adquisición progresiva de un número creciente de mutaciones que contribuyen a una enfermedad más avanzada. La presencia de una deleción secundaria (17p), la inactivación bialélica de los genes supresores de tumores, o ambas, se asocia con malos resultados.
Los cambios cromosómicos adicionales pueden incluir hiperdiploidía, definida como trisomía de los cromosomas 3, 5, 7, 9, 11, 15, 19 y/o 21 o la translocación t(11;14) que se observa en el 15 % al 20 % de los pacientes (provoca una sobre-expresión de ciclina-D1), pero no se asocian con peor pronóstico.
Bibliografía:
Cowan A. Diagnosis and Management of Multiple Myeloma A Review JAMA. 2022; 327(5): 464-477. doi:10.1001/jama.2022.0003

Lo sentimos, el formulario de comentarios está cerrado en este momento.