Medicamentos Biosimilares, un nueva alternativa de tratamiento en biológicos
Los medicamentos biosimilares son productos biofarmacéuticos como cualquier otro biológico, tanto en su complejidad como en su proceso de fabricación. Por definición, podemos decir que un biológico es una estructura proteíca compleja que ha sido fabricada o producida por un organismo vivo, mediante un proceso complejo de manufactura de varias etapas. [1]
Dentro de los productos biológicos podemos encontrar distintos tipos, que tendrán diferentes características, procedencia y grados de complejidad estructural. Algunas clases generales de biológicos son: [2]
– Sangre y otros derivados de la sangre (plaquetas)
– Terapias hormonales esteroideas (estrógenos, testosterona)
– Vacunas (para prevención de enfermedades)
– Antitoxinas (antiofídicos)
– Proteínas recombinantes (insulina, eritropoyetina)
– Ácidos nucleicos recombinantes (productos desarrollados para la hipercolesterolemia genética)
– Interleucinas (moléculas inmunes para el tratamiento de infecciones o cáncer)
– Material de trasplante (corneas, tendones, ligamentos)
– Anticuerpos monoclonales (tratamiento para enfermedades autoinmunes y cáncer)
– Terapias de células madre (para cáncer o enfermedades genéticas)
– Otras terapias celulares (células T para cáncer)
– Terapias génicas (para condiciones genéticas específicas)
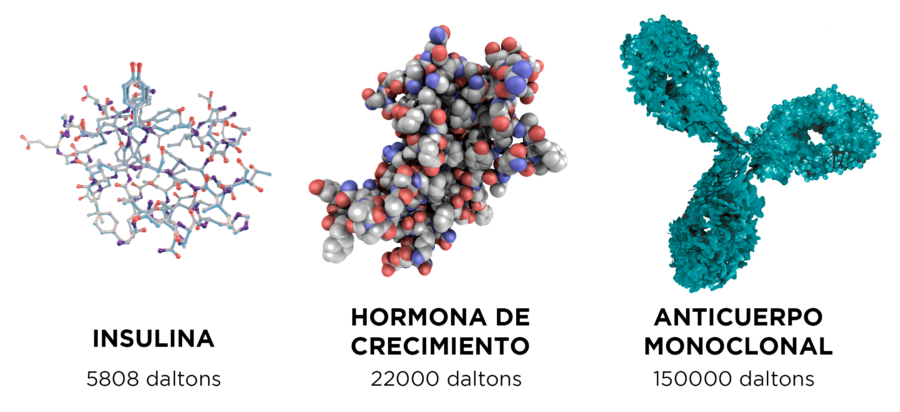
Ilustración 1. Ejemplos de moléculas biológicas para uso terapéutico de diferente complejidad estructural. [3]
¿Cómo se fabrica un biosimilar?
Los medicamentos biológicos y los biosimilares se fabrican mediante el uso de células vivas que se han modificado para producir proteínas terapéuticas en grandes cantidades. [4] [5]
Este proceso lo podemos dividir en tres fases,
· donde se establece un cultivo celular,
· se recupera y
· purifica el producto de interés y finalmente se distribuye el producto.
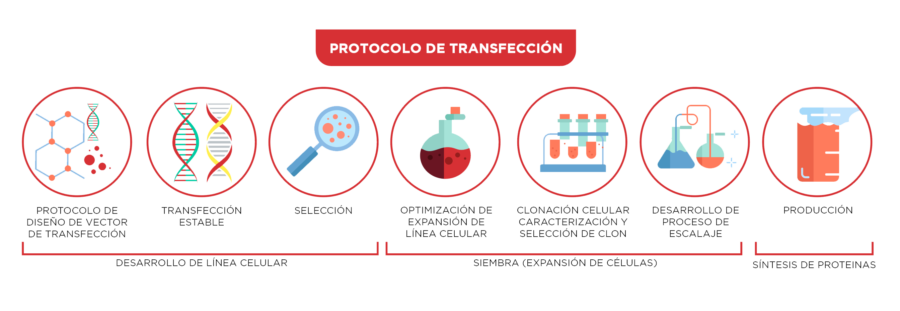
Ilustración 2. Cultivo celular de biosimilares. [6]
La primera fase del proceso de fabricación de Biosimilares es la fase de cultivo celular, que implica el crecimiento de grandes cantidades de células que producen una proteína terapéutica específica: [4]
- Desarrollo de la línea celular: proceso de creación de una línea de células que producirá el biosimilar; comienza con la ingeniería inversa de un producto de referencia, sigue con la transfección (introducción de material genético externo en las células mediante plásmidos u otras herramientas para la transferencia) y luego, con la selección de miles de células. A partir de estas células se crea un banco de células principal (único durante todo el ciclo de vida del producto) y bancos de células de trabajo (cientos de viales para garantizar la homogeneidad de la línea celular).
- Siembra (expansión de células): inicialmente, las células se colocan en matraces que contienen un caldo líquido con los nutrientes que las células requieren para su crecimiento. Durante el proceso de expansión, las células son secuencialmente transferidas a recipientes más grandes denominados biorreactores (algunos llegan a contener hasta 20.000 litros de células y medios de crecimiento). Los atributos clave de la funcionalidad del biosimilar son controlados muchas veces durante el proceso de expansión para garantizar que ninguno haya cambiado).
- Producción (síntesis de proteínas): ocurre en los grandes biorreactores de producción, donde las células producen una proteína específica que se convertirá en un medicamento biológico.
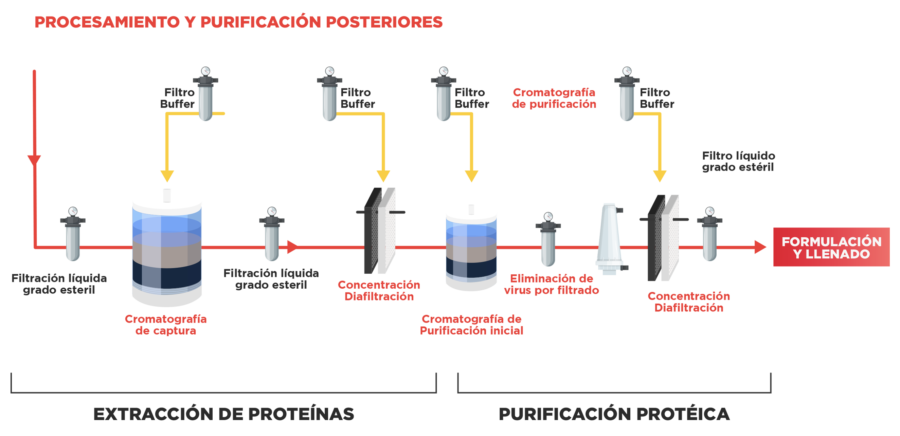
Ilustración 3. Extracción y purificación de proteínas. [7]
La segunda fase del proceso de fabricación de Biosimilares es la fase de recuperación y purificación: [8]
- Extracción de proteínas (recuperación): una vez que las células produjeron toda la proteína que pueden fabricar, la proteína terapéutica se separa de las células y del medio en el cual ha proliferado.
- Purificación proteica: la proteína se purifica para lograr el medicamento específico a través de muchos pasos (al menos 6). La purificación se basa en atributos específicos del producto como la estructura molecular, el tamaño y la carga eléctrica del producto para separarlo de las impurezas y lograr así los altos niveles de pureza que exigen los estándares internacionales. Posteriormente, la proteína se almacena en una solución amortiguadora y se transfiere a la operación de llenado.
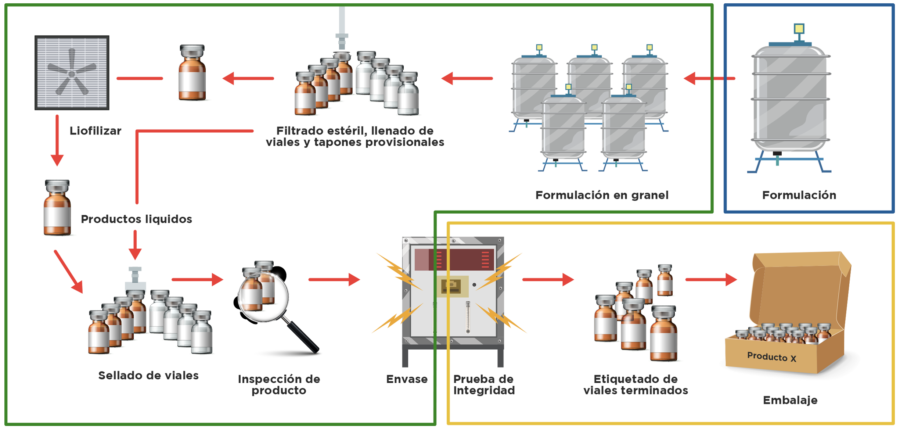
Ilustración 4. Formulación, envasado y distribución de biológicos. [8]
La fase final del proceso de fabricación de biosimilares es la formulación para la fase de distribución que, principalmente, consiste en preparar el biológico o biosimilar para el uso de los pacientes: [4]
- Llenado y acumulación: durante la formulación, la proteína terapéutica se coloca en una mezcla de componentes inertes para ayudar a garantizar que permanezca estable durante la distribución y el almacenamiento. El material a granel se formula dentro de depósitos que se transfieren al área de llenado, donde el producto es distribuido en viales o jeringas (o envasado), liofilizado o criodesecado de acuerdo al producto.
- Inspección (finalización): cada lote del producto se evalúa y se inspecciona exhaustivamente (el color, la transparencia y las partículas extrañas en los viales), tanto en forma manual como automatizada.
- Empaque y almacenamiento: los viales, las jeringas o los dispositivos requeridos para un proveedor de atención médica o paciente para la administración del producto se colocan en el embalaje junto con todos los insertos requeridos.
- Distribución: cada lote debe pasar todas las inspecciones y debe ser aprobado para la distribución. El producto envasado se envía a los distribuidores y, finalmente, se hace llegar a los pacientes.
Reconocimiento regulatorio
Actualmente, los biosimilares son una alternativa con buen perfil de costo-efectividad para el tratamiento biológico de distintas patologías; están disponibles en algunas regiones del mundo y presentan las garantías necesarias para proteger la seguridad de los pacientes. [3]
La Union Europea inició la aprobación de biosimilares en el año 2006 y hasta el 2020, ha otorgado el permiso de comercialización a 57 biosimilares de distintos productos
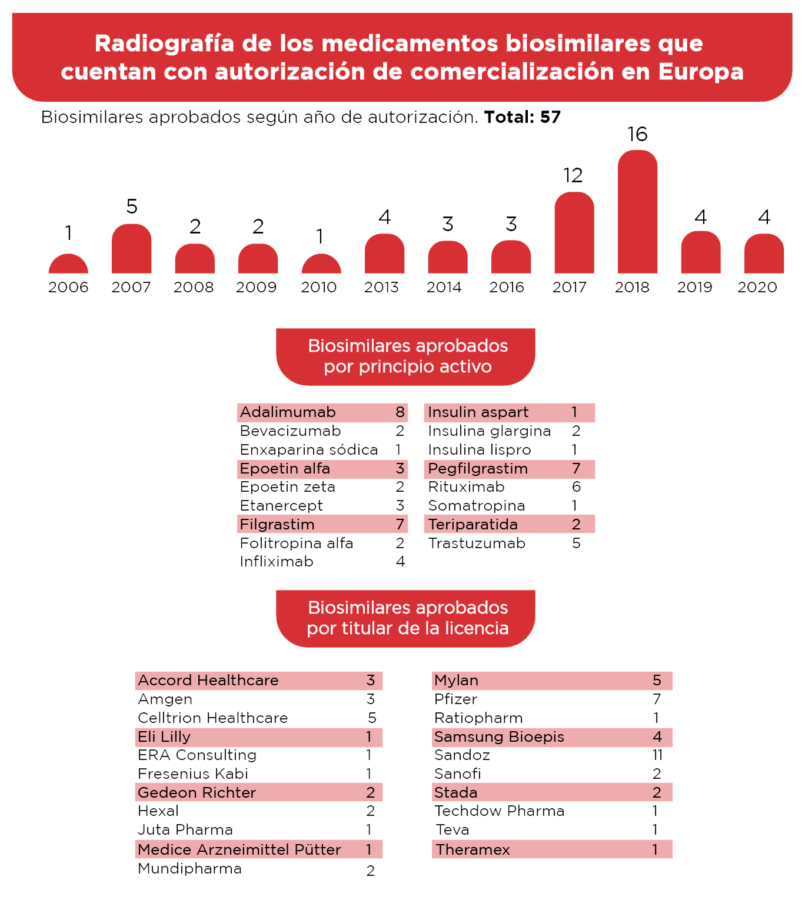
Ilustración 5. Biosimilares aprobados por EMA hasta la fecha. [9]
Por su parte, la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) también sostiene que los biosimilares son tan seguros y efectivos como el biológico de referencia; ambos son rigurosa y exhaustivamente evaluados por la FDA antes de ser aprobados [10], generando mayor confianza, tanto en el médico como el paciente, para optar por una alternativa biosimilar en el tratamiento de una patología autoinmune, genética o en cualquier tipo de cáncer.
FDA aprobó su primer biosimilar en 2015 y hasta el 2020, han dado el visto bueno a 28 biosimilares enfocados en distintas patologías. [10]
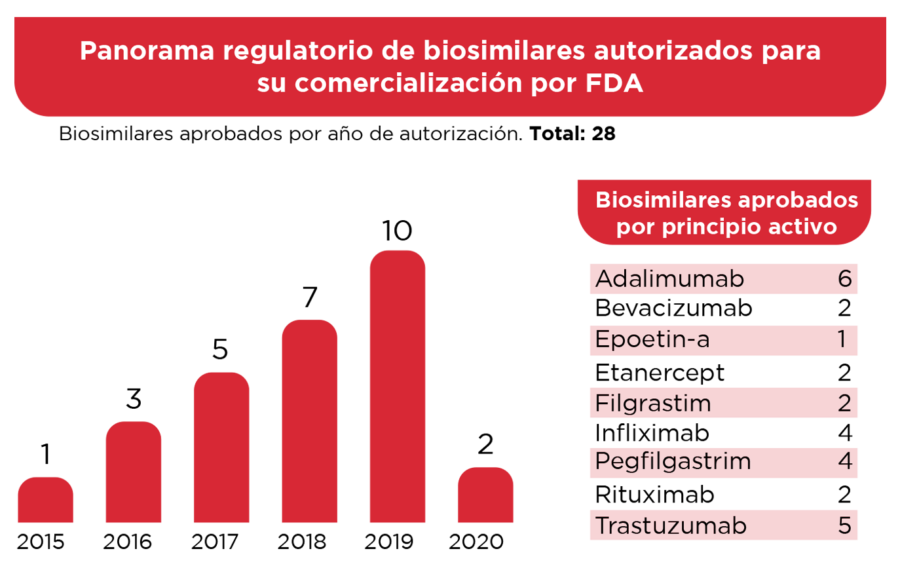
Ilustración 6. Biosimilares aprobados por FDA hasta la fecha. [10]
La decisión de tratamiento
Pensando en un mayor acceso a terapias de alto costo como la biológica, los biosimilares se convierten en un camino a considerar por parte del médico tratante para presentarla a su paciente y brindarle la confianza necesaria en el tratamiento y la consecuente mejora en la calidad de vida.
Referencias:
[1] G. J. O. Vulto, «The process defines the product: what really matters in biosimilar design and production?,» Rheumatology, pp. iv14-iv29, 2017.
[2] A. &. B. M. Ferro, « Biological therapies: a long way on from Jenner.,» British Journal of Clinical Pharmacology, vol. 76, nº 2, pp. 161-163, 25 junio 2013.
[3] Agencia Europea de Medicamentos, Comisión Europea, «Los Biosimilares en la UE, guía informativa para profesionales sanitarios,» EMA, Amsterdam, 2019.
[4] A. K. a. W. Zhou, «Mammalian Cell Cultures for Biologics Manufacturing,» Adv Biochem Eng Biotechnol, vol. 139, pp. 1-9, 2014.
[5] K. Ho, «Manufacturing Process of Biologics,» 2011. [En línea]. Available: https://www.ema.europa.eu/en/documents/presentation/presentation-manufacturing-process-biologics-kowid-ho-afssaps_en.pdf. [Último acceso: 27 oct 2020].
[6] Biotron-Healthcare, «Biotron Healthcare,» octubre 2020. [En línea]. Available: https://www.biotronhealthcare.com/cell-line-development/.
[7] N. B. C. a. C. NBCC, «Slide player,» octubre 2020. [En línea]. Available: https://slideplayer.com/slide/13274006/.
[8] F. González-Andrade, «Medicamentos biológicos, retos para desarrolladores, reguladores y proveedores de atención médica y pacientes.,» Quito, 2019.
[9] Diariofarma, «Diariofarma,» octubre 2020. [En línea]. Available: https://www.diariofarma.com/2020/07/08/el-numero-de-biosimilares-disponibles-en-la-union-europea-llega-a-57.
[10] F. Food and Drug Administration, «U.S. Food & Drug Administration,» octubre 2020. [En línea]. Available: https://www.fda.gov/consumers/articulos-en-espanol/biosimilares-y-biologicos-intercambiables-mas-opciones-de-tratamiento.

Lo sentimos, el formulario de comentarios está cerrado en este momento.