
EVALUACIÓN DE NOTIFICACIONES DE CASOS DE REACCIONES ADVERSAS A MEDICAMENTOS PARTE 2
¿Por qué evaluar la causalidad?
Un problema relativo a la farmacovigilancia es que la mayoría de los informes de casos se refieren a sospechas de reacciones adversas al fármaco. Las reacciones adversas rara vez son específicas del medicamento, las pruebas de diagnóstico suelen estar ausentes y una nueva exposición rara vez se justifica éticamente.
En la experiencia, pocas reacciones adversas son “definitivas” o “improbables”; la mayoría se encuentran en algún lugar entre estos extremos, es decir, “posible” o “probable”.

En un intento de resolver este problema se han desarrollado muchos sistemas para una evaluación estructurada y armonizada de la causalidad.
El sistema de la OMS-UMC ha sido desarrollado en consulta con los centros nacionales que participan en el Programa Internacional para el Monitoreo de Medicamentos y pretende ser un instrumento práctico para la evaluación de los casos. Se trata básicamente una evaluación combinada entre:
Las categorías de causalidad descritas por la Organización Mundial de la Salud y el Centro de Monitoreo Mundial de Uppsala (WHO – UMC) son las siguientes:
1.- Definitiva (Certain): un acontecimiento clínico, incluyendo alteraciones en las pruebas de laboratorio, que se manifiesta con una secuencia temporal plausible en relación con la administración del medicamento, y que no puede ser explicado por la enfermedad concurrente, ni por otros fármacos o sustancias. La respuesta a la supresión del fármaco (retirada; dechallenge) debe ser plausible clínicamente. El acontecimiento debe ser definitivo desde un punto de vista farmacológico o fenomenológico, utilizando, si es necesario, un procedimiento de re-exposición (rechallenge) concluyente.
2. Probable (Probable, Likely): un acontecimiento clínico, incluyendo alteraciones en las pruebas de laboratorio, que se manifiesta con una secuencia temporal razonable en relación con la administración del medicamento, que es improbable que se atribuya a la enfermedad concurrente, ni a otros fármacos o sustancias, y que al retirar (dechallenge) el fármaco se presenta una respuesta clínicamente razonable. No se requiere tener información sobre re-exposición (rechallenge) para asignar esta definición.
3. Posible (Possible): un acontecimiento clínico, incluyendo alteraciones en las pruebas de laboratorio, que se manifiesta con una secuencia temporal razonable en relación con la administración del medicamento, pero que puede ser explicado también por la enfermedad concurrente, o por otros fármacos o sustancias. La información respecto a la retirada del medicamento puede faltar o no estar clara.
4. Improbable (Unlikely): un acontecimiento clínico, incluyendo alteraciones en las pruebas de laboratorio, que se manifiesta con una secuencia temporal improbable en relación con la administración del medicamento, y que puede ser explicado de forma más plausible por la enfermedad concurrente, o por otros fármacos o sustancias.
5. Condicional/No clasificada (Conditional/ Unclassified): un acontecimiento clínico, incluyendo alteraciones en las pruebas de laboratorio, notificado como una reacción adversa, de la que es imprescindible obtener más datos para poder hacer una evaluación apropiada, o los datos adicionales están bajo examen.
6. No evaluable/ Inclasificable (Unassessable/Unclassifiable): una notificación que sugiere una reacción adversa, pero que no puede ser juzgada debido a que la información es insuficiente o contradictoria, y que no puede ser verificada o completada en sus datos.
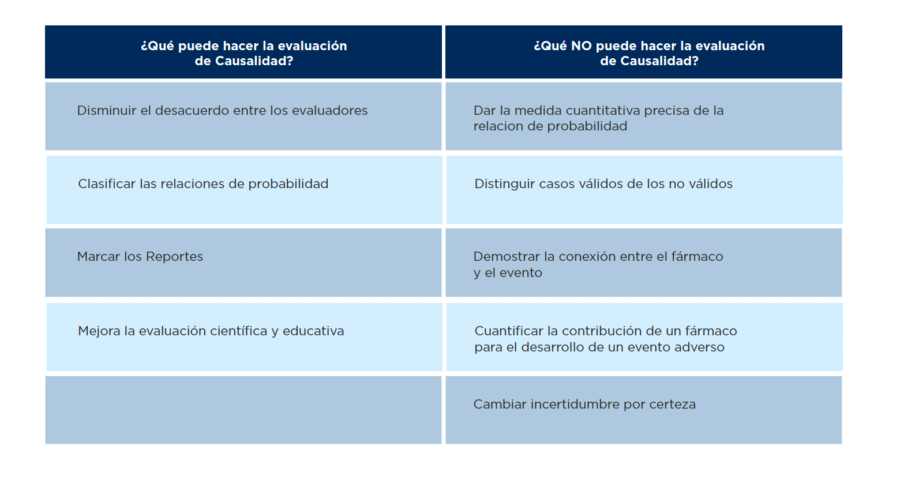
Es importante resaltar que, ninguno de los sistemas de evaluación de causalidad han demostrado producir una estimación cuantitativa precisa y confiable de la probabilidad de relación. Los avances y limitaciones de la evaluación de causalidad se revisan en la tabla 1.
Tabla 1.- Avances y limitaciones de la evaluación estandarizada de la causalidad de los casos.
Referencias bibliográficas:
1.- Organización Panamericana de la Salud. Buenas Prácticas de Farmacovigilancia. Washington, D.C.: OPS; 2011 (Red PARF Documento Técnico; 5). https://iris.paho.org/handle/10665.2/51553
2.- Uppsala Monitoring Centre (the UMC), WHO Collaborating Centre for International Drug Monitoring; ISBN 91-631-1561-1. Vigilancia de la Seguridad de los Medicamentos https://www.who-umc.org/media/1707/24751.pdf

Lo sentimos, el formulario de comentarios está cerrado en este momento.