Cardiotoxicidad en tratamientos oncológicos
El tratamiento del cáncer ha tenido una evolución espectacular; a la cirugía que fue el primer tratamiento, se sumaron progresivamente la radioterapia, la quimioterapia citotóxica y en los últimos años la terapia dirigida y la inmunoterapia. Todos los tratamientos han contribuido en el incremento exponencial de las tasas de supervivencia de los pacientes que a su vez provoca la irrupción de complicaciones que en los primeros tiempos eran difíciles de observar como los problemas cardiovasculares1. Dichos trastornos constituyen en la actualidad la segunda causa principal de morbilidad a largo plazo así como de mortalidad entre los supervivientes de cáncer2.
Epidemiología
La incidencia de trastornos cardiovasculares asociados a los tratamientos oncológicos varía ampliamente de acuerdo con el tipo de terapia utilizada, la duración de estos tratamientos, así como de las comorbilidades subyacentes del paciente3. Se ha observado por ejemplo en el cáncer de mama que las mujeres a largo plazo tienen un incremento significativo del riesgo de muerte por enfermedad cardiovascular que podría superar inclusive al riesgo provocado por el cáncer inicial o su recurrencia, una población con alto impacto en la aparición de dicha patología lo constituyen mujeres jóvenes entre los 24 a 44 años4. L patología cardiovascular podría ser un proceso natural en los pacientes, para dilucidar esto se ha observado el comportamiento de la patología cardiovascular en los niños; por ejemplo el Estudio de los Niños Supervivientes de Cáncer demostró que a los 15 a 25 años del diagnóstico los supervivientes tienen 8.2 veces más riesgo de muerte cardiaca comparado con sus controles. Comparado de igual manera con sus controles presentan 15 veces mayor riesgo de insuficiencia cardiaca y 9 veces mayor riesgo para enfermedad cerebrovascular isquémica5.
Gráfico 1: Comparación de Riesgos de complicaciones post quimioterapia en pacientes pediátricos a los 35 años de edad5,*
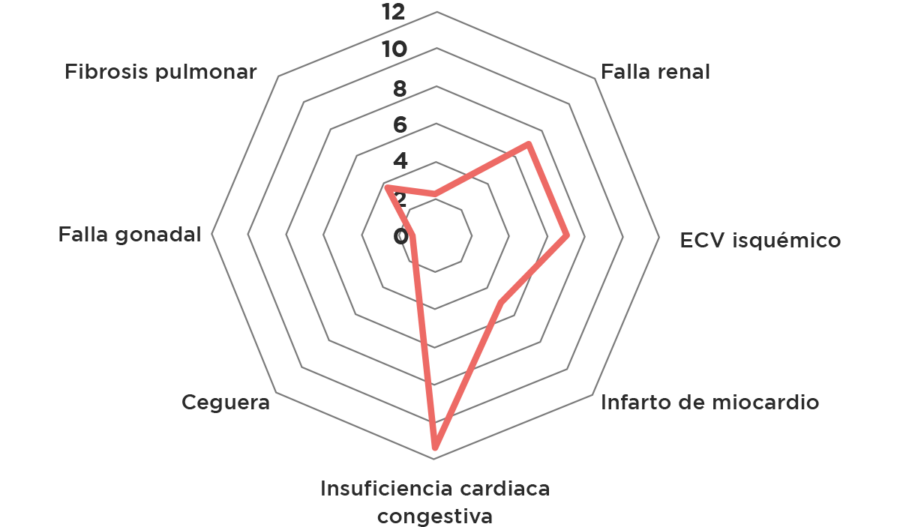
* De todos los riesgos evaluados solamente las complicaciones cardiovasculares tuvieron intervalos de confianza que no cruzaron el valor 1.
La quimioterapia citotóxica y la cardiotoxicidad.
La revolución del tratamiento del cáncer sacó a la luz muchas terapias de diversos orígenes; desde antibióticos pasando por derivados de gases utilizados en la guerra hasta productos vegetales o toxinas fúngicas entre muchas otras fuentes se generaron los tratamientos que hasta hoy mantienen vigencia y brindan resultados en diversidad de tumores6.
Medicamentos de grupos como taxanos, antimetabolitos, antibióticos, etc. Han sido efectivos; sin embargo, pueden provocar cardiotoxicidad.
Gráfico 2: Cardiotoxicidad leve de los distintos medicamentos antineoplásicos en estudios fase II o III* 7-12.
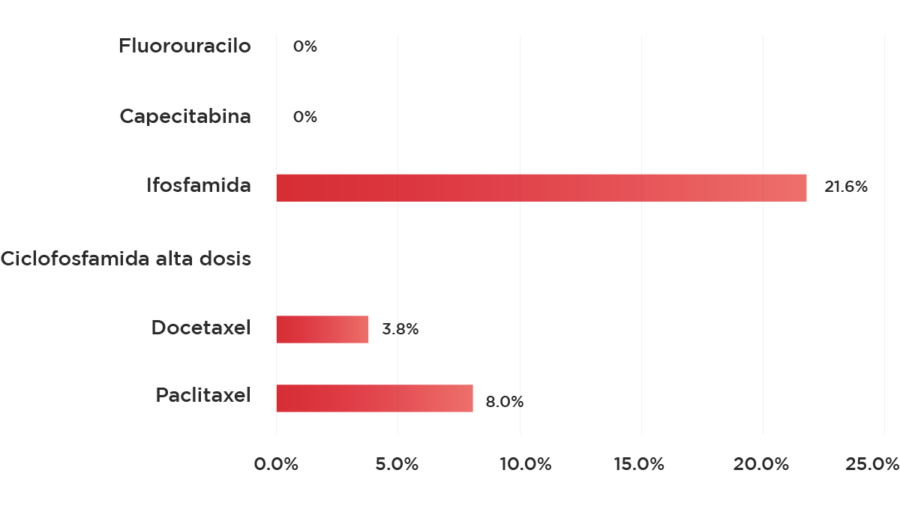
* Si bien en algunos estudios se encuentran bajas tasas de cardiotoxicidad leve, hay otros en los que puede hallarse mayores valores, en el presente caso se buscaron estudios con monoterapia en la página clinical trials, el encontrar estudios con resultados que clasifiquen la toxicidad presenta alguna dificultad en las investigaciones anteriores con más de 20 años.
Gráfico 3: Cardiotoxicidad severa de los distintos medicamentos antineoplásicos en estudios fase II o III* 7-12.
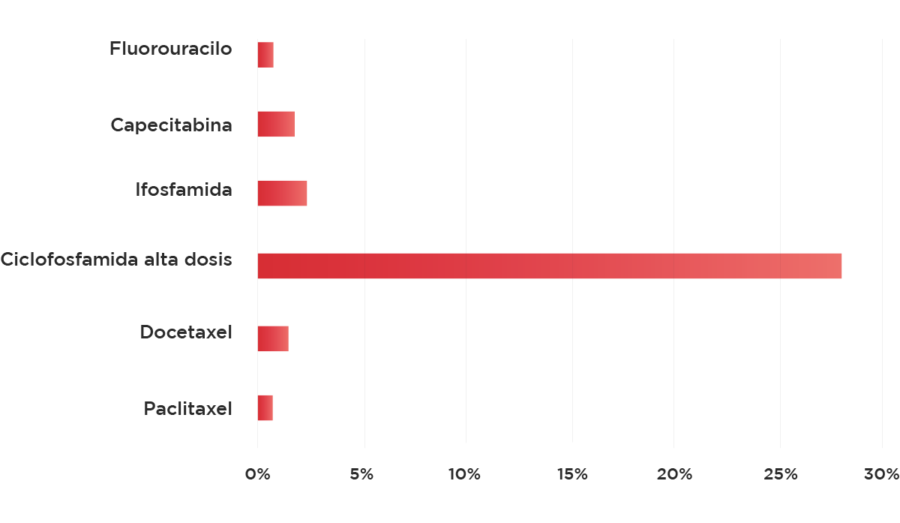
* Es difícil la utilizaciónd e ciclofosfamida en altas dosis , y en el caos de ifosfamida se encontró estudios en la base de datos conmbinado con platino.
El caso de las antraciclinas.
Descubiertas en la década de 1950-1959, las antraciclinas han formado un eje en el tratamiento de tumores sólidos y hematológicos por su alta eficacia13. Los efectos de las antraciclinas se han estudiado y abarcan algunos como son: a) intercalación con pares de bases de ADN (Acido Desoxirribonucleico) y posterior estabilización del complejo II-alfa de la topoisomerasa (enzimas que actúan en el ADN, enrollándolo para facilitar su almacenamiento como desenrollándolo a fin de permitir la síntesis proteica como la replicación), después del clivaje de ADN y que contribuye a su ruptura y b) la prevención de la síntesis de ADN y ARN14.
Y a estos mecanismos cruciales en la eficacia se han estudiado mecanismos relacionados con el efecto de la cardiotoxicidad: a) estrés oxidativo, que en la presencia de hierro, genera radicales libres de oxígeno que a su vez provocan la peroxidación de los lípidos de las membranas que deriva finalmente en el daño a los miocitos, y b)inhibición de la topoisomerasa II beta, que puede resultar en la activación de las vías de muerte celular y la inhibición de la biogénesis mitocondrial15.
Los factores de riesgo identificados para incrementar la probabilidad de toxicidad por antraciclinas: una edad mayor de 65 años o menor de 18 años, el género femenino, la dosis acumulativa de antraciclina, la presencia de enfermedad valvular, disfunción basal ventricular izquierda, hipertensión arterial, etnia afroamericana, insuficiencia renal, exposición concomitante a la radiación, exposición al trastuzumab o combinada de radiación y trastuzumab, sobecarga de hierro y factores genéticos16.
Dentro de los factores expuestos previamente, estudiaremos a la dosis acumulativa. En varios estudios se encontró que la dosis acumulativa presenta incremento del riesgo de cardiotoxicidad, son clásicos los estudios de Von Hoff, Swain y Ryberg que fundamentan dos conceptos. El primero es que sobe una dosis acumulativa de 400 mg/m2 (equivalente a 8 ciclos de quimioterapia con esquema CHOP) el riesgo se incrementa de gran manera; y el segundo concepto, es que dosis menores aunque en menor proporción, también pueden causar cardiotoxicidad o dicho en otras palabras dosis terapéuticas no son 100% inocuas desde el punto de vista cardiológico17-19.
Gráfico 4: Toxicidad acumulativa de Doxorrubicina y Epirrubicina17-19 .
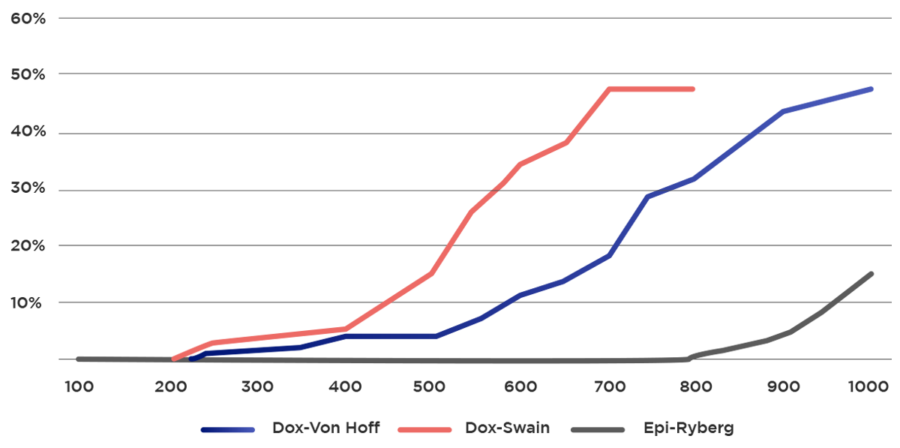
Dox: Doxorrubicina, Epi: Epirrubicina.
Cardiotoxicidad con terapias blanco.
Los tratamientos blancos pueden ocasionar también afectación cardiovascular; en caso de inhibidores de la tirosin-quinasa se han encontrado varios eventos. En la siguiente tabla se detallan los eventos grado 3-4 en estudios pivotales.
Tabla 1: Eventos cardiacos grado 3-4 relacionados con inhibidores de tirosin-quinasa (%)20-25:
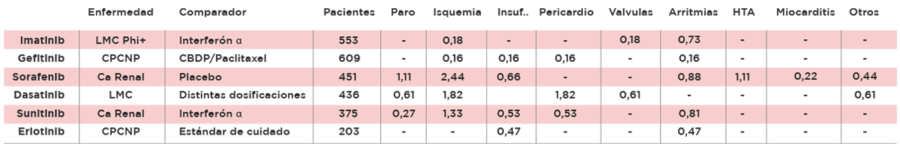
LMC Phi+: Leucemia Mieloide Crónica con Cromosoma Philadelphia, CPCNP: Cáncer de Pulmón de células no pequeñas, Ca: Cáncer, LMC: Leucemia Mieloide Crónica, CBDP: carboplatino, Isquemia: abarca infarto y otros grupos de isquemia, Insuficiencia: incluye disfunción ventricular, Pericardio: incluye derrame y pericarditis, Arritmias: incluye de bradi a taquiarritmias, HTA: Hipertensión Arterial, Otros: incluye Cor pulmonale entre otros.
En la terapia blanco puede haber afectación cardiovascular; para comparar con el grupo terapéutico que más efectos cardiovasculares genera como son las antraciclinas, hay dificultad para la comparación. La razón es por cuanto los estudios de dichas antraciclinas presentan dificultades para desglosar los efectos, sin embargo, la toxicidad es menor con las nuevas terapias aunque sea un punto para un control y soporte por el médico cardiólogo.
Conclusiones
· Los tratamientos oncológicos pueden tener relación con eventos adversos cardiovasculares.
· Aunque hay varios tratamientos que pueden causar estos eventos, las antraciclinas constituyen el grupo terapéutico que más riesgo podría tener.
· La cardiotoxicidad por antraciclinas se relaciona con la exposición acumulada a dichas drogas.
Bibliografía
1.- McCune, J. (2018). Rapid Advances in Immunotherapy to Treat Cancer. Clinical Pharmacology & Therapeutics, 103(4), 540-544. doi: 10.1002/cpt.985.
2.- Siegel, R., DeSantis, C., Virgo, K., Stein, K., Mariotto, A., & Smith, T. et al. (2012). Cancer treatment and survivorship statistics, 2012. CA: A Cancer Journal For Clinicians, 62(4), 220-241. doi: 10.3322/caac.21149.
3.- Curigliano, G., Cardinale, D., Dent, S., Criscitiello, C., Aseyev, O., Lenihan, D., & Cipolla, C. (2016). Cardiotoxicity of anticancer treatments: Epidemiology, detection, and management. CA: A Cancer Journal For Clinicians, 66(4), 309-325. doi: 10.3322/caac.21341.
4.- Bodai, B. (2019). Breast Cancer Survivorship: A Comprehensive Review of Long-Term Medical Issues and Lifestyle Recommendations. The Permanente Journal, 19(2). doi: 10.7812/tpp/14-241.
5.- Armstrong, G., Kawashima, T., Leisenring, W., Stratton, K., Stovall, M., & Hudson, M. et al. (2014). Aging and Risk of Severe, Disabling, Life-Threatening, and Fatal Events in the Childhood Cancer Survivor Study. Journal Of Clinical Oncology, 32(12), 1218-1227. doi: 10.1200/jco.2013.51.1055.
6.- DeVita, V., & Chu, E. (2008). A History of Cancer Chemotherapy. Cancer Research, 68(21), 8643-8653. doi: 10.1158/0008-5472.can-07-6611.
7.- Shulman, L., Cirrincione, C., Berry, D., Becker, H., Perez, E., & O’Regan, R. et al. (2012). Six Cycles of Doxorubicin and Cyclophosphamide or Paclitaxel Are Not Superior to Four Cycles As Adjuvant Chemotherapy for Breast Cancer in Women With Zero to Three Positive Axillary Nodes: Cancer and Leukemia Group B 40101. Journal Of Clinical Oncology, 30(33), 4071-4076. doi: 10.1200/jco.2011.40.6405.
8.- Johnson & Johnson Pharmaceutical Research & Development, L.L.C. (2021). A Study of Docetaxel Monotherapy or DOXIL and Docetaxel in Patients With Advanced Breast Cancer – Full Text View – ClinicalTrials.gov. Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00091442
9.- Gottdiener, J. (1981). Cardiotoxicity Associated With High-Dose Cyclophosphamide Therapy. Archives Of Internal Medicine, 141(6), 758. doi: 10.1001/archinte.1981.00340060066015.
10.- Powell, M. (2021). Paclitaxel and Carboplatin or Ifosfamide in Treating Patients With Newly Diagnosed, Persistent or Recurrent Uterine, Ovarian, Fallopian Tube, or Peritoneal Cavity Cancer – Full Text View – ClinicalTrials.gov. Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00954174
11.- Roché, H., Conte, P., Perez, E., Sparano, J., Xu, B., & Jassem, J. et al. (2010). Ixabepilone plus capecitabine in metastatic breast cancer patients with reduced performance status previously treated with anthracyclines and taxanes: a pooled analysis by performance status of efficacy and safety data from 2 phase III studies. Breast Cancer Research And Treatment, 125(3), 755-765. doi: 10.1007/s10549-010-1251-y
12.- Pfizer CT.gov Call Center. (2021). Comparing Irinotecan and 5 FU/FA To 5-FU/FA After Resection Of Liver Metastases For Colorectal Cancer – Full Text View – ClinicalTrials.gov. Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00143403.
13.- Volkova, M., & Russell, R. (2012). Anthracycline Cardiotoxicity: Prevalence, Pathogenesis and Treatment. Current Cardiology Reviews, 7(4), 214-220. doi: 10.2174/157340311799960645.
14.- Tewey, K., Rowe, T., Yang, L., Halligan, B., & Liu, L. (1984). Adriamycin-induced DNA damage mediated by mammalian DNA topoisomerase II. Science, 226(4673), 466-468. doi: 10.1126/science.6093249.
15.- Zhang, S., Liu, X., Bawa-Khalfe, T., Lu, L., Lyu, Y., Liu, L., & Yeh, E. (2012). Identification of the molecular basis of doxorubicin-induced cardiotoxicity. Nature Medicine, 18(11), 1639-1642. doi: 10.1038/nm.2919.
16.- Saleh, Y., Abdelkarim, O., Herzallah, K., & Abela, G. (2020). Anthracycline-induced cardiotoxicity: mechanisms of action, incidence, risk factors, prevention, and treatment. Heart Failure Reviews. doi: 10.1007/s10741-020-09968-2.
17.- Von Hoff, D. (1979). Risk Factors for Doxorubicin-lnduced Congestive Heart Failure. Annals Of Internal Medicine, 91(5), 710. doi: 10.7326/0003-4819-91-5-710.
18.- Swain, S., Whaley, F., & Ewer, M. (2003). Congestive heart failure in patients treated with doxorubicin. Cancer, 97(11), 2869-2879. doi: 10.1002/cncr.11407.
19.- Ryberg, M., Nielsen, D., Skovsgaard, T., Hansen, J., Jensen, B., & Dombernowsky, P. (1998). Epirubicin cardiotoxicity: an analysis of 469 patients with metastatic breast cancer. Journal Of Clinical Oncology, 16(11), 3502-3508. doi: 10.1200/jco.1998.16.11.3502.
20.- Safety and Efficacy of Imatinib Versus Interferon-α Plus Cytarabine in Patients With Newly Diagnosed Philadelphia Chromosome Positive Chronic Myelogenous Leukemia – Full Text View – ClinicalTrials.gov. (2021). Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00333840.
21.- First Line IRESSA™ Versus Carboplatin/Paclitaxel in Asia – Full Text View – ClinicalTrials.gov. (2021). Retrieved 1 March 2021, from https://www.clinicaltrials.gov/ct2/show/NCT00322452.
22.- Study of BAY43-9006 in Patients With Unresectable and/or Metastatic Renal Cell Cancer – Full Text View – ClinicalTrials.gov. (2021). Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00073307.
23.- Chronic Myelogenous Leukemia (CML) – Follow on: Study of BMS-354825 in Subjects With CML – Full Text View – ClinicalTrials.gov. (2021). Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00123474.
24.- SU011248 Versus Interferon-Alfa As First-Line Systemic Therapy For Patients With Metastatic Renal Cell Carcinoma – Full Text View – ClinicalTrials.gov. (2021). Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00083889.
25.- A Study of Tarceva (Erlotinib) and Standard of Care Chemotherapy in Patients With Advanced, Recurrent, or Metastatic Non-Small Cell Lung Cancer (NSCLC) – Full Text View – ClinicalTrials.gov. (2021). Retrieved 1 March 2021, from https://clinicaltrials.gov/ct2/show/NCT00556322.


Lo sentimos, el formulario de comentarios está cerrado en este momento.