
Informes Periódicos de Seguridad y su importancia en la Gestión de Farmacovigilancia
De acuerdo con la Organización Panamericana de la Salud, los informes periódicos de seguridad son “documentos solicitados por las autoridades regulatorias a los titulares de la autorización de uso, en los que se resume la información global actualizada sobre la seguridad de un medicamento, vacuna o biotecnológico, consolidada por el titular” (OPS, 2021). El objetivo de estos informes es presentar un análisis exhaustivo, conciso y crítico de la relación riesgo-beneficio del medicamento, considerando la información nueva o emergente en el contexto de la información acumulada sobre riesgos y beneficios (European Medicines Agency, 2013).
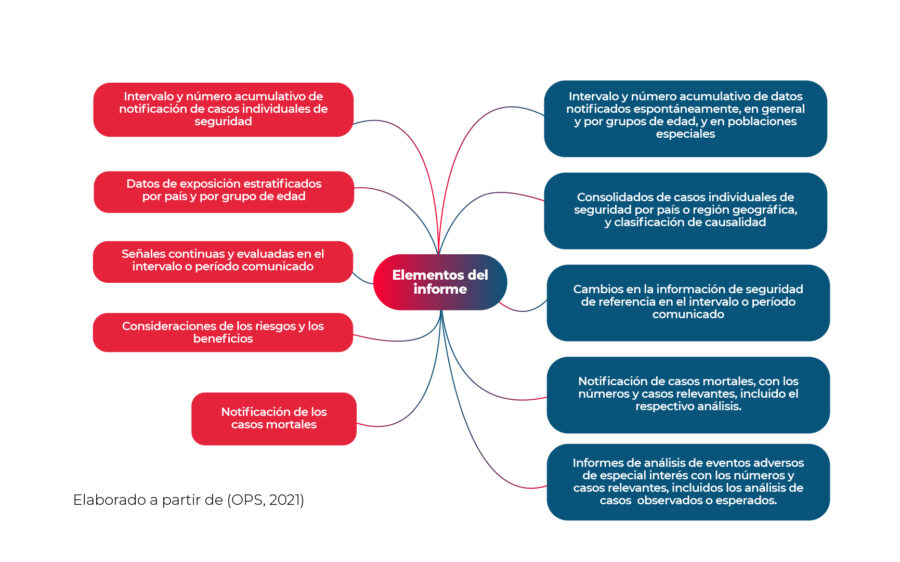
Principios para la evaluación del balance riesgo-beneficio en Informes Periódicos de Seguridad.
La evaluación de riesgos y beneficios debe efectuarse a lo largo del ciclo de vida del medicamento con el propósito de promover y proteger la salud pública y mejorar la seguridad del paciente. Esta evaluación debe:
- Resumir las acciones de minimización de riesgos que se hayan llevado a cabo, implementado o que se planean implementar durante el período del informe (European Medicines Agency, 2013).
- Detallar planes para evaluaciones de señales o riesgos, incluyendo plazos y propuestas para actividades adicionales de farmacovigilancia (European Medicines Agency, 2013).
- Examinar detenidamente la información que ha surgido durante el período del informe para determinar si ha generado nuevas señales (European Medicines Agency, 2013).
- Resumir de manera crítica la nueva información relevante acerca de seguridad, eficacia y efectividad que pueda impactar el balance riesgo-beneficio del medicamento (European Medicines Agency, 2013).
- Realizar un análisis integrado de riesgo-beneficio para todas las indicaciones autorizadas, basándose en la información acumulada disponible desde la fecha de inicio internacional del desarrollo (European Medicines Agency, 2013).
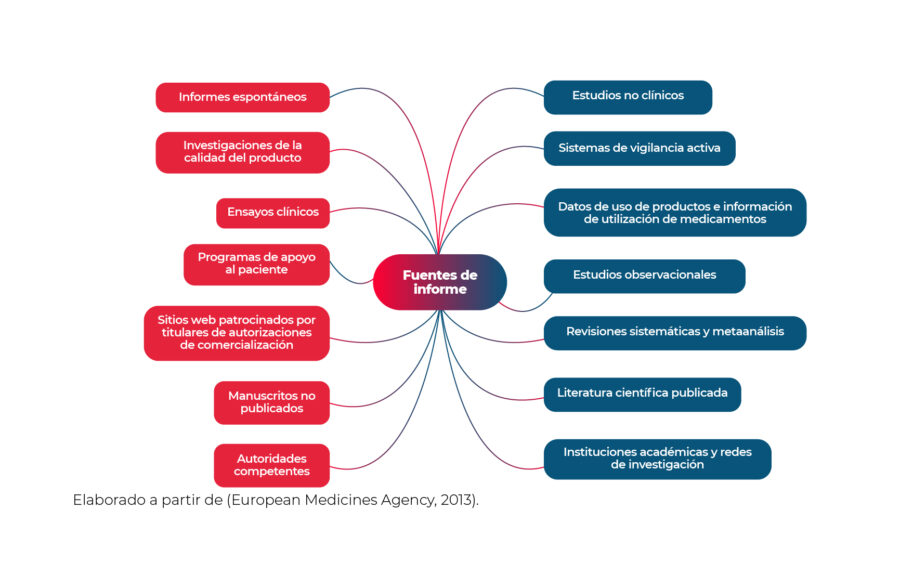
Fuentes de información sobre eficacia, efectividad y seguridad utilizables en la preparación de informes periódicos de seguridad.
Casos que deben incluirse
- Todas las reacciones graves y reacciones no graves no enlistadas, provenientes de notificaciones espontáneas (European Medicines Agency, 2006).
- Todas las reacciones graves obtenidas de estudios o del uso designado por el paciente (European Medicines Agency, 2006).
- Todas las reacciones graves y reacciones no graves no enlistadas, procedentes de la literatura (European Medicines Agency, 2006).
- Todas las reacciones graves informadas por las autoridades regulatorias (European Medicines Agency, 2006).
Criterios utilizados para definir la frecuencia de presentación
- Información sobre riesgos o beneficios que puedan impactar la salud pública.
- Nuevos productos para los cuales la información de seguridad disponible hasta la fecha es limitada.
- Cambios significativos en el producto.
- Poblaciones de pacientes vulnerables, poblaciones de pacientes poco estudiadas e información faltante.
- Indicaciones de potencial mal uso, errores en la medicación, riesgo de sobredosis o dependencia.
- El volumen de la base de datos de seguridad y la exposición al medicamento.
- Medicamentos sujetos a seguimiento adicional (European Medicines Agency, 2013).

Conclusión:
Los informes periódicos de seguridad, subrayados por la Organización Panamericana de la Salud y la European Medicines Agency, son esenciales para garantizar la seguridad y eficacia de los medicamentos a lo largo de su ciclo de vida. Estos informes requieren un análisis crítico y constante de la relación riesgo-beneficio, incorporando tanto datos históricos como emergentes, y considerando múltiples fuentes de información, incluyendo poblaciones vulnerables y casos espontáneos. Esta vigilancia rigurosa y adaptable asegura que los medicamentos sean seguros y efectivos para todos los grupos demográficos y en circunstancias cambiantes.
Bibliografía.
- European Medicines Agency. (2006). E 2 C (R1) Clinical Safety Data Management: Periodic Safety Update Reports for Marketed Drugs. https://www.ema.europa.eu/en/documents/scientific-guideline/ich-e-2-c-r1-clinical-safety-data-management-periodic-safety-update-reports-marketed-drugs-step-5_en.pdf
- European Medicines Agency. (2013). Guideline on good pharmacovigilance practices (GVP) Module VII – Periodic safety update report (Rev 1). https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-good-pharmacovigilance-practices-gvp-module-vii-periodic-safety-update-report_en.pdf
- OPS. (2021). Planes de gestión de riesgos e informes periódicos de seguridad de las vacunas contra la COVID-19 Recomendaciones para la solicitud, preparación, manejo y evaluación. https://iris.paho.org/bitstream/handle/10665.2/53362/OPSHSSMTCOVID-19210003_spa.pdf?sequence=5&isAllowed=y

Lo sentimos, el formulario de comentarios está cerrado en este momento.